Tính tốc độ trung bình của phản ứng
Nhân dịp xuân 2023, Toan Đỗ xin chúc Quý bạn và Gia đình SỨC KHỎE – HẠNH PHÚC – THÀNH ĐẠT. Hôm nay là 30 âm lịch rồi, hãy chuẩn bị đón giao thừa và cùng học cách tính tốc độ trung bình nha!.

Tính tốc độ trung bình của phản ứng
Nội dung bài viết
Bạn cần đọc lại bài vỡ lòng về tốc độ phản ứng hóa học trước khi đọc tiếp lí thuyết dưới đây.
1. Nhắc lại tốc độ phản ứng
Chúng mình đang tìm cách tính tốc độ trung bình của chiếc xe hơi như hình dưới đây:

Theo vật lý, tốc độ trung bình (tức giả vờ chỉ chuyển động đều) của chiếc xe tính dễ ẹt, lấy Quãng đường : Thời gian là xong. Giả bộ:
- quãng đường từ A đến B dài 90 km,
- xe chạy từ A đến B mất 3 giờ,
- vậy tốc độ trung bình của xe là 90km : 3h = 30km/h.
- nghĩa là xe chạy đều đều, luôn luôn giữ tốc độ không đổi là 30km/h – cho dù có gặp ổ gà, khúc cua, khi đường vắng, ….
Hóa học cũng tính như vậy;
- nhưng thay vì Quãng đường, ta dùng Nồng độ mol (kí hiệu là CM ; đơn vị là moli/lit hay ghi tắt là M) của chất phản ứng, chất sản phẩm.
- công thức sẽ là Nồng độ (M) : Thời gian (h, m, s).
- khi đó đơn vị của tốc độ trung bình là M/h ; M/m hoặc M/s tùy giá đơn vị thời gian ta dùng.
2. Nồng độ trong công thức trên tính làm sao?
Vì trong 1 đơn vị thời gian, tốc độ là
- lượng giảm nồng độ của chất phản ứng, hoặc
- lượng tăng nồng độ của chất sản phẩm.
Nên ta phải tính được lượng tăng – giảm nồng độ. Muốn tính tăng – giảm bao nhiêu, Hóa học qui định (hoặc thực tế mình cũng thấy như vậy) lấy Nồng độ sau – Nồng độ đầu là xong á!
Các bài tập sau sử dụng các giá trị nồng độ giả vờ; nhưng giúp dễ để hiểu. Bạn cần đọc và suy nghĩ kỹ càng sẽ thấy dễ lắm! Nếu vẫn chưa rõ, bạn ghi vào phần comment bên dưới để cùng học nha.
2.1. Bài 1_Cho phản ứng tưởng tượng với 2 chất phản ứng A, B;
tạo sản phẩm là chất C và tất cả hệ số cân bằng là 1.
***Tính toán
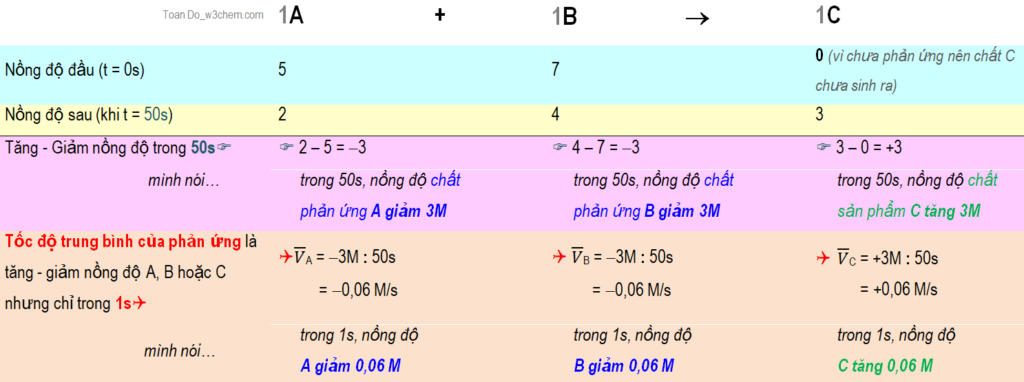
- Nhưng… tốc độ tính theo A, B ra số âm thì kỳ quá à (mặc dầu dấu âm có ý nghĩa là giảm), do vậy trong công thức tính tốc độ theo chất phản ứng, người ta thêm dấu trừ (-) vào phía trước, để giá trị tốc độ ra số dương, nghĩa là thế này:
vtrung bình tính theo A hoặc B = – (Lượng giảm) : Thời gian = – (-3M) : 50s = 0,06 M/s
- Còn tốc độ tính theo chất sản phẩm C thì sẵn ra số dương rồi thì… thôi. Nhưng ở một vài tài liệu, trong công thức tổng quát; người ta vẫn cố tình thêm dấu cộng (+) vào… để nhấn mạnh sự tăng nồng độ!
vtrung bình tính theo C = + (Lượng tăng) : Thời gian = +(3M) : 50s = 0,05 M/s
***Kết quả
Ta thấy cho dù tính theo chất A, B hay C thì 1 phản ứng chỉ có 1 giá trị tốc độ thôi á, để còn so sánh tốc độ với phản ứng khác nữa chứ!
2.2. Bài 2_Cho phản ứng tưởng tượng với 2 chất phản ứng A, B;
tạo sản phẩm là chất C và các hệ số cân bằng không còn là 1 nữa, mà lần lượt là 1-3-2 như dưới đây:
Đến đây, khi tính toán, mình sẽ tự động
- thêm dấu âm (-) vào khi tính với chất phản ứng A, B.
- bỏ thêm dấu dương (+) vào khi tính với chất sản phẩm C cho gọn đẹp.
***Tính toán

Trời ơi! Nếu tính như trên thì thấy cùng 1 phản ứng nhưng có tới 3 giá trị tốc độ phản ứng,
- tính theo chất phản ứng A ra 0,04 M/s.
- tính theo chất phản ứng B ra 0,12 M/s.
- tính theo chất sản phẩm C ra 0,08 M/s.
Vậy lấy số nào bây giờ? Làm sao so sánh được với tốc độ của phản ứng khác?
***Vì sao 1 phản ứng lại có nhiều giá trị tốc độ?
Điểm khác ở hai bài trên là hệ số cân bằng:
- Bài 1 là 1A + 1B → 1C
- Bài 2 là 1A + 3B → 2C
Nghĩa là:
- Bài 1 mình đang tính toán với tỉ lệ: một A, một B khi phản ứng sẽ tạo thành một C.
- Bài 2 mình đang tính toán với tỉ lệ: một A, ba B khi phản ứng sẽ tạo thành hai C.
Chính do tỉ lệ A, B, C khác nhau ở bài 2, khiến giá trị nồng độ mol-cũng là giá trị tốc độ phản ứng khác nhau (cần nghiền ngẫm đôi chút!!!!). Vậy phải làm sao bây giờ?
Các nhà khoa học khôn lắm, họ mới nghĩ ra cách: chuyển các giá trị tốc độ về tỉ lệ các chất đều là một (1). Khi đó chắc chắn 1 phản ứng chỉ có 1 giá trị tốc độ, và chắc chắn số này là có lý khi dùng so sánh với phản ứng bất kỳ khác.
***Giải quyết
Dễ lắm, giống như quy tắc tam suất hay dùng, cụ thể:
- Với 1 A thì v = 0,04 ⇒ đã là 1 rồi thì thôi.
- Với 3 B thì v = 0,12 ⇒ vậy với 1 B thì v = 0,12 : 3 = 0,04.
- Với 2 C thì v = 0,08 ⇒ vậy với 1 C thì v = 0,08 : 2 = 0,04.
Có phải mình làm thêm thao tác là CHIA CHO HỆ SỐ CÂN BẰNG để qui về tỉ lệ 1 không nào? Và bây giờ, bài 2 chỉ còn một giá trị tốc độ thôi. Toán chia thì dễ ẹt phải không nào?
3. Công thức tính tốc độ trung bình của phản ứng
Chỉ cần đọc kỹ 2 bài tập giả vờ trên, mình sẽ có công thức tính tốc độ trung bình giản dị. Lấy đại phản ứng
aA + bB → cC
trong đó a, b, c là các hệ số cân bằng, ta tính theo 3 bước:
[1] Tính thời gian gian phản ứng (kí hiệu Δt) là Δt = tsau – tđầu, dễ quá!
[2] Tính biến thiên (tăng-giảm) nồng độ (kí hiệu ΔC) là ΔC = Csau – Cđầu ; và tự dưng ta thấy:
- với chất phản ứng A, B thì ΔC ra số âm do Csau < Cđầu.
- với chất sản phẩm C thì ΔC ra số dương do Csau > Cđầu.
[3] Tốc độ trung bình của phản ứng có thể tính theo A, B hay C cũng được; công thức như thế này nè:
- tính theo chất phản ứng A, B: NHỚ thêm dấu âm vào để kết quả tốc độ ra số dương. Dấu âm cũng có ý chỉ nồng đồ A, B giảm dần theo thời gian.

- tính theo chất sản phẩm C: đương nhiên ra số dương. Nhưng đôi khi có tài liệu vẫn thêm dấu + để nhấn mạnh sự tăng nồng độ!

Và khi đã chia cho hế số cân bằng (a, b, c); thì cho dù tính theo chất nào đi chăng nữa, mình cũng chỉ thu được 1 giá trị tốc độ trung bình thôi à.
Tác giả: Đỗ Trọng Toan từ W3chem.com
4. Tài liệu tham khảo thêm về tốc độ phản ứng
Mời các bạn đọc thêm các bài viết cao cấp về Tốc độ phản ứng tiếng Anh tại (lưu ý không dành cho người yếu tim!):
5. Liên kết nhanh
Đọc thêm các bài viết của Hóa lớp 10 tại đây.
Mình là người tự mình thực hiện toàn bộ dự án này – bao gồm xây dựng trang web, viết nội dung, tìm tài liệu tham khảo. Vui lòng xem xét QUYÊN GÓP để hỗ trợ W3chem CHỈ BẰNG CÁCH CHIA SẺ BÀI VIẾT NÀY LÊN MẠNG XÃ HỘI; bởi vì trong tương lai, bạn sẽ cho mình nhiều thời gian để làm việc trên W3chem, cũng có nghĩa bạn có thể nhận thêm nhiều nội dung mới nhanh hơn tại W3chem.
Mình cảm ơn bạn rất nhiều ⤵







