pH cho biết dung dịch có tính acid, base hay trung tính
Quảng cáo xà bông Dove có nói đến trị pH = 5.5. Khán giả nghe hay hay… nhưng chưa chắc đã hiểu gì. Bởi vì, đằng sau pH dễ thương là một câu truyện dài thật dài.

pH viết tắt từ “potential of Hydrogen” (tiềm lực của hydrogen… ???). 𓀤
pH là con số đẹp; tuy ngắn gọn nhưng giúp mình biết được dung dịch (dung môi là H2O) có tính acid, base hay trung tính. 𓀦
Nội dung bài viết
1. Bảng dò pH cho người chưa biết
1.1. Dễ lắm, mình dò trị pH với bảng sau là biết liền 👩
| Nếu | thì dung dịch có tính |
| 0 ≤ pH < 7 | acid |
| pH = 7 | trung tính |
| 7 < pH ≤ 14 | base |
🦜 Thang pH (từ 0 đến 14) và vài dung dịch thực tiễn tương ứng:
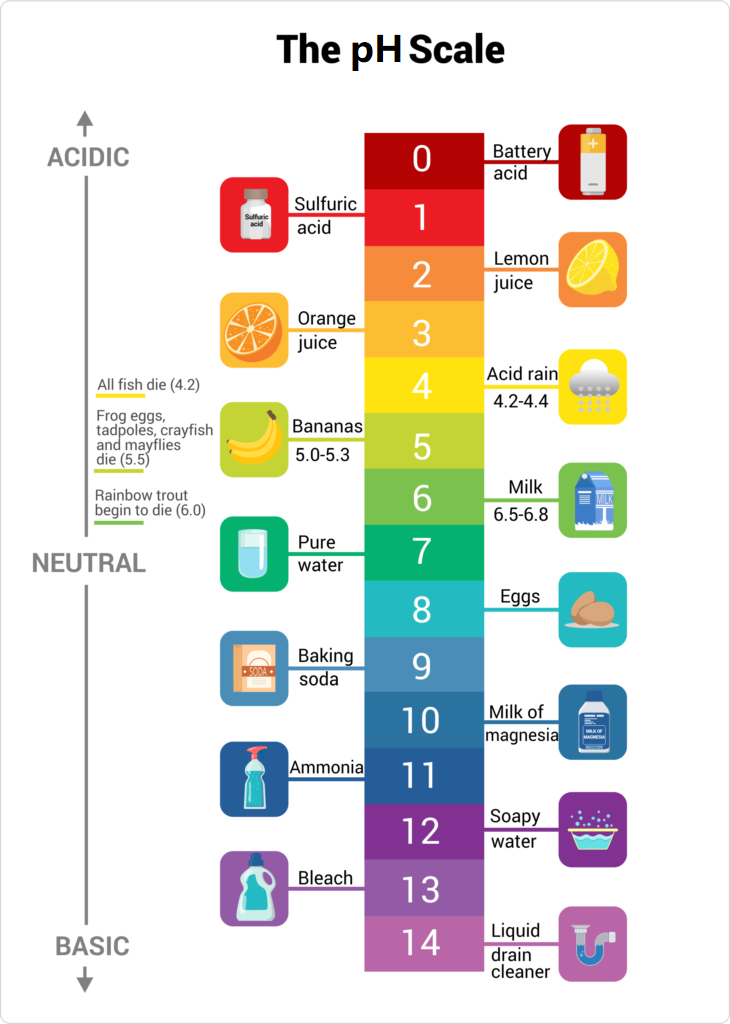
Ở bài Acid Base là chất gì? mình đã có vài công thức, bây giờ đem ra sử dụng nha!
1.2. Dùng công thức pH + pOH = 14 🐠
…(sẽ có bạn thắc mắc; nhưng để đời vui, mình xem lại bài cũ hoặc đơn giản hơn ….công nhận là vậy!), mình có thang pH và pOH liên quan như sau:
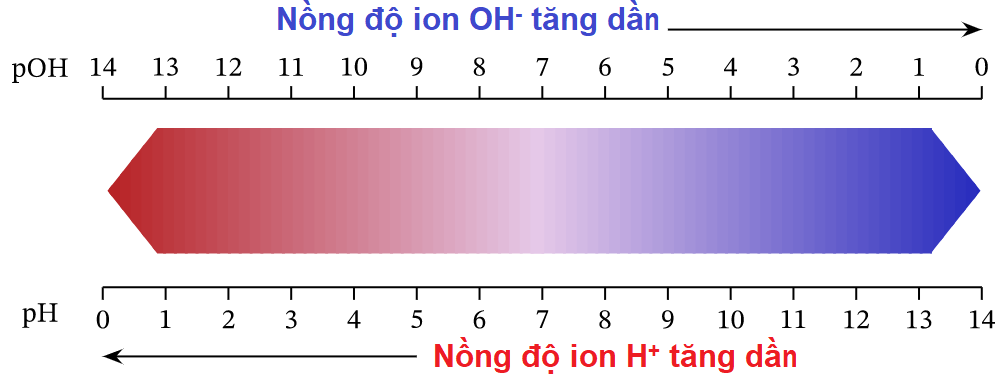
1.3. Tiếp tục dùng 2 công thức sau, 🦜
mình sẽ hiểu vì sao nồng độ ion OH–, H+ biến đổi như trên:
- pH = a ⇔ [H+] = 10-a
- pOH = b ⇔ [OH–] = 10-b
Mình sẽ có hình vẽ tiếp theo như sau, cần lưu ý
- 🏡🗽📣 100 = 1 nha bạn; nên nếu [H+] = 100 thì có nghĩa là [H+] = 1 mol/lit.
- số mũ âm càng lớn thì số càng nhỏ, ví dụ 10-5 < 10-3 (vì 10-5 = 0,00001 ; trong khi 10-3 = 0,001).

1.4. Gom lại, mình có bảng sau 👩
| Nếu | thì dung dịch có tính | Nồng độ H+ (mol/lit) |
| 0 ≤ pH < 7 | acid | 10-7 < [H+] ≤ 100 (1) |
| pH = 7 | trung tính | [H+] = 10-7 |
| 7 < pH ≤ 14 | base | 10-14 ≤ [H+] < 10-7 |
1.5. Thực nghiệm tìm trị pH của dung dịch
🥤 Dùng chất chỉ thị axit-bazơ (chất chuyển thành chất có màu khi gặp môi trường axit, base) riêng lẻ như quỳ tím, phenolphtalein ⇒ khoảng giá trị pH.
Giấy tẩm quỳ tím (Litmus paper) sẽ
- từ màu tím đổi thành màu đỏ nếu pH ≤ 6 (môi trường acid)
- không đổi màu (vẫn màu tím) nếu 6 < pH < 8 (môi trường trung tính; acid-kiềm yếu)
- từ màu tím đổi thành màu xanh nếu pH ≥ 8 (môi trường kiềm)
- cách làm: nhúng giấy quỳ tím vào dung dịch cần đo, nhìn ngắm có/không có sự đổi màu; kết luận pH
Dung dịch phenolphtalein (PP) không màu sẽ
- vẫn không màu nếu pH < 8,3
- hóa thành màu hồng nếu pH ≥ 8,3
- cách làm: nhỏ PP vào dung dịch cần đo, quan sát có/không có sự đổi màu; kết luận pH. Thường PP dùng để xác định môi trường kiềm
🍹 Dùng giấy tẩm hỗn hợp nhiều chất chỉ thị axit-bazơ (thường gọi là chất chỉ thị vạn năng) ⇒ gần đúng trị pH.
- cách làm: nhúng giấy thử vào dung dịch cần đo, sẽ có sự đổi màu. Mình đem so với bộ màu (tương ứng với trị pH in sẵn) để tìm pH.
- xem hình so màu dưới đây

🧃 Dùng máy đo pH ⇒ chính xác trị pH.
- cách làm: phức tạp hơn chút; máy đơn giản dùng cho người dân khá dễ, còn máy dùng trong phòng thí nghiệm thì khi học ĐH hoặc đi làm về Hóa sẽ biết.
2. Toán tính pH của dung dịch dạng ngây thơ
2.1. Tính pH của dung dịch axit mạnh
- Viết phương trình điện li
- Tính nồng độ ion H+. Nếu cho sẵn nồng độ axit thì lấy tính luôn; nếu không thì tính [H+] = molH+ : Vdd
- Dùng công thức pH = – lg[H+] để tính là xong.
2.1. Tính pH của dung dịch base mạnh
- Viết phương trình điện li
- Tính nồng độ ion OH–. Nếu cho sẵn nồng độ base thì lấy tính luôn; nếu không thì tính [OH–] = molOH- : Vdd
- Dùng công thức pOH = – lg[OH–]
- Rồi tính pH bằng công thức pH + pOH = 14
- 🤔Một số trường bắt tính [OH–] xong thì tính [H+] từ biểu thức [H+].[OH–] = 10-14; cuối cùng tính pH = -lg[H+].
3. Liên kết nhanh
Đọc thêm các bài viết của Hóa lớp 11 tại đây.
Viết bởi Đỗ Trọng Toan từ W3chem.com
Mình là người tự mình thực hiện toàn bộ dự án này – bao gồm xây dựng trang web, viết nội dung, tìm tài liệu tham khảo, trả lời câu hỏi bạn gởi về. Vui lòng xem xét QUYÊN GÓP để hỗ trợ W3chem CHỈ BẰNG CÁCH CHIA SẺ BÀI VIẾT NÀY LÊN MẠNG XÃ HỘI; bởi vì trong tương lai, bạn sẽ cho mình nhiều thời gian để làm việc trên W3chem, cũng có nghĩa bạn có thể nhận thêm nhiều nội dung mới nhanh hơn tại W3chem. 😍 🥰 😘
Mình cảm ơn bạn rất nhiều ⤵






