Lớp và phân lớp electron, hướng dẫn tìm số electron tối đa
Lớp và phân lớp electron là khái niệm dễ hiểu của Hóa 10, nhưng khiến bạn hiểu lầm vỏ nguyên tử như vỏ trái cây; thật ra là sự phân loại mức năng lượng của electron. Như hình dưới đây, kí hiệu chỉ năng lượng tăng dần của electron.

Tiêu chuẩn để electron di chuyển trong AO của mình chính là năng lượng nó mang trong người! Và cách nói lớp, phân lớp cũng chỉ là tượng trưng cho mức năng lượng của electron.
Nếu khó hiểu, hãy đọc lại ví dụ đã học sau: Tôi (electron) ở vila kế biển (AO) ⇔ tôi thuộc phân lớp siêu giàu ⇔ tôi ở lớp thượng lưu ⇔ tôi rất nhiều tiền (nhiều năng lượng).
Nội dung bài viết
1. Lớp và phân lớp electron (hoặc AO) đều ám chỉ mức năng lượng của electron
1.1. Lớp và phân lớp electron
Lớp: chứa các electron có mức năng lượng GẦN bằng nhau. Có 7 lớp – đánh số từ 1 đến 7 hoặc kí hiệu tương ứng là K, L, M, N, O, P, Q.
Phân lớp trong 1 lớp: chứa các electron có mức năng lượng BẰNG nhau. Có 4 loại phân lớp – kí hiệu là s, p, d, f.
1.2. Số electron tối đa trong phân lớp s, p, d, f
| Phân lớp | s | p | d | f |
| Số AO | 1 | 3 | 5 | 7 |
| Số electron max | 2 | 6 | 10 | 14 |
| Kí hiệu | s2 | p6 | d10 | f14 |
1.3. Số electron tối đa của lớp 1 đến lớp 7 (K, L, M, N, O, P, Q)

1.3.1. Bé tập đọc
Bạn hãy đọc dọc từ trên xuống dưới như dưới đây:
- Lớp thứ 1 (kí hiệu K), có 1 phân lớp (kí hiệu 1s), có 1 Orbital, chứa tối đa 2 electron.
- Lớp thứ 2 (kí hiệu L), có 2 phân lớp (kí hiệu 2s-2p), có 4 Orbital, chứa tối đa 8 electron.
- Lớp thứ 3 (kí hiệu M), có 3 phân lớp (kí hiệu 3s-3p-3d), có 9 Orbital, chứa tối đa 18 electron.
- Lớp thứ 4 (kí hiệu N), có 4 phân lớp (kí hiệu 4s-4p-4d-4f), có 16 Orbital, chứa tối đa 32 electron.
Từ lớp 5, 6, 7 hao hao giống nhau, bạn hãy đọc tiếp:
- Lớp thứ 5 (kí hiệu O), có 4 phân lớp (kí hiệu 5s-5p-5d-5f), có 16 Orbital, chứa tối đa 32 electron.
- Lớp thứ 6 (kí hiệu P), có 4 phân lớp (kí hiệu 6s-6p-6d-6f), có 16 Orbital, chứa tối đa 32 electron.
- Lớp thứ 7 (kí hiệu Q), có 4 phân lớp (kí hiệu 7s-7p-7d-7f), có 16 Orbital, chứa tối đa 32 electron.
1.3.2. Công thức chỉ đúng từ lớp 1 – lớp 4
Lớp thứ n (n = 1, 2, 3, 4) có
- n phân lớp electron.
- n2 Orbital
- tối đa 2n2 electron
1.3.3. Bé viết theo các mũi tên chéo
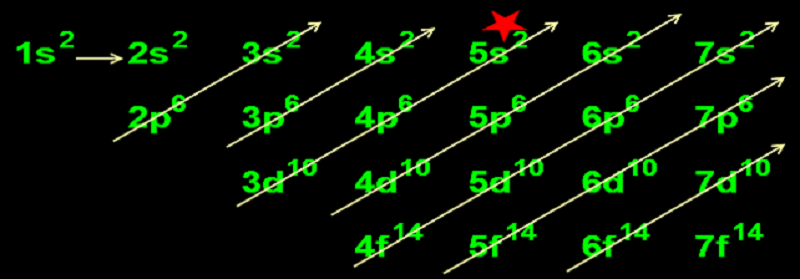
Để xài cho phần dưới, bé đọc theo từng mũi tên một và lần lượt viết ra cho đúng thứ tự; ta có dãy sau:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 (chỗ đánh dấu ngôi sao*) 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6 6f14 7d10 7f14.
Nhớ số mũ là số electron tối đa ở phân lớp đó. Vậy theo dãy này, ta lấy các số mũ cộng lại thì tổng số electron tối đa là 156 (hoặc lấy số electron max của 7 lớp cộng lại – bạn xem lại hình trên).
2. Qui tắc đường chéo của ông Klech-kow-ski
Bạn nhìn vào những đường chéo, đọc từng mũi tên một và lần lượt viết ra (xem 1.3.3); kết quả thu được là dãy MỨC NĂNG LƯỢNG TĂNG DẦN CỦA CÁC AO như sau:

Hiểu như sau:
- Năng lượng của phân lớp 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < …* (dãy còn dài …đến 7f là kết thúc; tuy nhiên tuổi teen chỉ cần học thuộc đế chỗ đánh dấu NGÔI SAO là quá đủ).
- Số mũ là số electron tối đa của phân lớp đó.
Nhớ số ghi trước không phải là toán nhân; đơn giản chỉ là kí hiệu lớp thứ mấy. Ví dụ
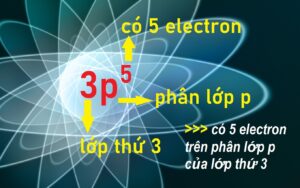
- Ghi 2p ⇔ 1 phân lớp 2p, đọc là phân lớp p ở lớp thứ 2.
- Ghi 3s ⇔ 1 phân lớp 3s, đọc là phân lớp s ở lớp thứ 3.
Số mũ chỉ số electron tối đa của phân lớp đó. Ví dụ
- Ghi 2p6 ⇔ có tối đa 6 electron trên phân lớp 2p.
- Tùy nguyên tử, có thể là 2p4 ⇔ có 4 electron trên phân lớp 2p.
- Nhưng sai nếu bạn ghi 2p7 (hoặc số lớn hơn) ; bởi vì ………
Bạn phải học thuộc lòng dãy này để xác định loại nguyên tố và viết cấu hình electron sau này; đây là nội dung quan trọng và dùng suốt đời học sinh 3 năm lớp 10, 11, 12.
3. Liên kết nhanh
Đọc thêm bài viết về Nguyên tử và Hóa lớp 10 tại đây.
Viết bởi Đỗ Trọng Toan từ W3chem.com
Mình là người tự mình thực hiện toàn bộ dự án này – bao gồm xây dựng trang web, viết nội dung, tìm tài liệu tham khảo, trả lời câu hỏi bạn gởi về. Vui lòng xem xét QUYÊN GÓP để hỗ trợ W3chem CHỈ BẰNG CÁCH CHIA SẺ BÀI VIẾT NÀY LÊN MẠNG XÃ HỘI; bởi vì trong tương lai, bạn sẽ cho mình nhiều thời gian để làm việc trên W3chem, cũng có nghĩa bạn nhận thêm nhiều nội dung mới nhanh hơn tại đây.😍 🥰 😘







Cho em hoi co nguyen tu nao dat den muc nang luong 7f14 khong a
*Câu hỏi hay nha Việt.
*Như lí thuyết mình thấy, muốn đạt đến mức 7f14 thì nguyên tử đó phải có 156 electron; một số electron quá lớn mà đến nay-thế kỉ 21, các nhà khoa học vẫn chưa tìm ra nguyên tử nào có số electron như vậy. Nhưng dự đoán là có, vấn đề rất khó là tìm ra thế nào?
*Với trình độ KHKT và trí thông minh của con người thế kỉ 21, các nhà KH mới chỉ tìm ra nguyên tố có số Z khoảng 118. Vì sao như vậy?
Các nguyên tử có số Z (số electron) càng lớn thì càng khó để phát hiện và tìm hiểu xem tính chất của chúng thế nào; bởi vì các nguyên tử này có tuổi thọ rất ngắn (khoảng vài mili giây à!, thậm chí còn ít hơn nữa, đến độ chưa xác định được luôn! Nó sinh ra rồi tự dưng biến mất, con người chưa kịp trở tay gì….).
Cũng có một số bài báo nói cách ta xác định về lớp-phân lớp electron như hiện nay là sai gì đó …tương lại sẽ thay đổi và vì vậy, cũng làm thay đổi cách sắp xếp – hình dạng của bảng tuần hoàn luôn.
Nhưng thôi, đó là chuyện xa lắm… ; mình nên để dành cho các nhà khoa học làm việc.
*Chúng mình yên tâm rằng, không bao giờ có bài tập với nguyên tố có số Z lớn hơn dãy mình đang học. Nếu chuyện đó xảy ra thì …ghê gớm lắm.
Mình nhớ đến 5s^2 (đạt 38 electron như bài học trên) là quá đủ cho môn Hóa.
*Còn bây giờ, vui học và làm bài tập thôi nào! và …nhớ giữ nguyên tắc 5K mùa dịch Covid-19 nha Việt. Thân.
Cho em hỏi là vì sao phân lớp s trong mọi lớp đều có số lượng AO là 1 ạ.Em xin cảm ơn ạ
Minh thân.
Cũng như bàn tay, cho dù ở đất nước nào, hay ở tầng lớp nào trong xã hội; luôn có 5 NGÓN (nên người ta có lời hát…Bàn tay 5 ngón em vẫn kiêu sa…). Đó là điều kỳ diệu của Tạo hóa; mà không bao giờ chúng ta thắc mắc vì sao là 5 ngón mà không phải 1, 2, 6, 7…? Chúng ta chỉ tìm hiểu, khám phá và học cách sử dụng 5 ngón tay đó…
Cấu tạo nguyên tử trong Hóa học (hay cấu tạo tế bào môn Sinh học) cũng do Tạo hóa tác thành; chúng ta có lẽ không bao giờ trả lời được câu hỏi: Vì sao phân lớp s trong mọi lớp đều chỉ có 1 AO, mà không phải là 2, 3,… (Tạo hóa có lý do hợp lí của mình). Con người chỉ dùng trí thông minh và máy móc (đến nay là thế kỉ 21) để tính toán, tìm tòi và phát hiện ra như thế; rồi dùng lí thuyết – lập luận để giải thích – chứng minh – thuyết phục điều phát hiện là đúng.
Vậy cuối cùng, chúng ta ghi nhận lí thuyết trên là 1 điều hiển nhiên của Tạo hóa (cũng như Mặt trời mọc ở hướng đông, lặn ở hướng tây vậy).
Nếu có ai đó giải thích này nọ, thì đó chính là đang dùng sự hiểu biết của mình để chứng minh điều hiển nhiên kia là đúng!.
Và nếu có những vấn đề không trả lời được, mình sẽ trả lời (và luôn đúng nha Minh): TỰ NHIÊN NÓ VẬY!!!!! (vì thế mà con người xếp môn Lý – Hóa – Sinh là môn Khoa Học TỰ NHIÊN!!!!!).
Cảm ơn Minh đã có câu hỏi rất thú vị. Hẹn gặp lại Minh ở các câu hỏi khác.
Vậy dạ thưa ad là vì sao người ta gọi là AO có năng lượng là yếu hay mạnh để electron chiếm ạ
Như CÂU TRẢ LỜI BÊN DƯỚI, mỗi electron mang trong mình năng lượng lớn hay nhỏ-là điều TỰ NHIÊN (cũng như mọi loài, mọi vật, kể cả con người cũng mang năng lượng vậy!).
*Con người thắc mắc, tìm tòi nghiên cứu và phát hiện ra những sự thật hiển nhiên ấy.
*Và cách gọi AO (hay vô số các kí hiệu khác trong khoa học) chỉ là cách mà con người kí hiệu qui ước thôi.
*Vậy gốc vấn đề là BẢN THÂN ELECTRON mang năng lượng nhỏ, lớn; và …con người đưa ra các kí hiệu để biểu diễn, truyền đạt thông tin.
Xem câu bên dưới nha Hoàng; còn thắc mắc thì hỏi nha.
Thầy ơi electron thì có hạt mang năng lượng mạnh, có hạt mang năng lượng yếu phải ko ạ.
Nếu tiện thì thầy giúp em luôn là năng lượng của electron là tự nhiên mà có, nghĩa là random sẽ có e mạnh, e yếu hay sao ạ.
MONG THẦY DUYỆT Ạ.
Để hiểu tường tận vì sao e lại mang năng lượng (liên quan đến môn Vật lý), Hoàng phải học Hóa bậc Đại học thì rõ liền; nhưng thôi, cứ đọc thử phần đơn giản sau để có khái niệm.
*Hai dạng năng lượng dễ hiểu nhất là
1) Động năng-năng lượng tích tụ do chuyển động. Chuyển động càng nhanh thì năng lượng càng to! Vì vậy mà mình thấy:
-Hai xe chạy chậm, nếu va vào nhau thì chẳng hề gì; nhưng nếu tốc độ trên 100km thì chao ôi – tan nát!. Bởi vì chuyển động nhanh thì năng lượng tích tụ trong mỗi chiếc xe rất lớn; sự va chạm khiến chúng giải phóng năng lượng bên trong ra – hậu quả là 2 xe tan tành!.
-Xem clip (trên Youtube) phóng 1 cây kim vào tấm kiếng; cây kim xuyên thủng luôn tấm kiếng (mà nếu ta chỉ cầm kim chạm vào mặt kiếng thì không thể). Bởi vì người phóng đã làm cây kim chuyển động nhanh-tức làm cây kim tích tụ trong mình 1 năng lượng lớn, khiến có có thể đâm thủng kiếng.
2) Thế năng-năng lượng có được do khoảng cách, độ cao. Độ cao càng lớn thì năng lượng càng to! Vì vậy mà mình thấy:
-Một vật càng trên cao, khi rơi xuống đất thì nát bét – do năng lượng tích tụ trong vật đó lớn.
-Nhà cao 4 tầng, đế bồn nước trên tầng 4 thì nước ở vòi nước khi mở sẽ chảy mạnh nhất ở tầng trệt.
*Cũng vậy, electron tích tụ năng lượng Động năng (do nó chuyển động nhanh quanh hạt nhân); và Thế năng (do nó có khoảng cách với hạt nhân); và … còn dạng năng lượng gì nữa thì Thầy cũng hổng biết luôn! Chắc sau này Hoàng học để ý nha.
*Nếu mình lưu ý thì thấy mỗi người đều có 2 dạng năng lượng trên – một cách rất TỰ NHIÊN.
Câu hỏi hay… nhưng khó để hiểu tường tận.
Còn thắc mắc thì hỏi nha Hoàng.
Tình cờ đọc các câu trả lời của Thầy thấy hay và đáng trân quý. Cảm ơn vì học sinh may mắn vẫn còn học những người Thầy thế này. Chúc Thầy nhiều sức khỏe và thành coing trong công tác.
Chào Hòa.
Rất cảm ơn lời khen của em. Thầy sẽ cố gắng học hỏi thêm để đưa ra câu trả lời tốt nhất trong khả năng hiểu biết của mình.
Cám ơn Hòa một lần nữa. Chúc em & gia đình sức khỏe. Mong gặp lại em ở các bài viết khác.
Trân trọng.
cảm ơn thầy vì những kiến thức thầy đã chia sẻ ạ
Cám ơn Phương đã đọc bài viết.
Mong gặp lại em ở các bài học khác.
Trân trọng.
Tình cờ em đọc được những câu hỏi của các bạn và những câu trả lời của thầy em thấy rất thú vị em mong rằng sau này vẩn còn nhiều giáo viên tận tụy với nghề như thầy ạ
Chào Lâm.
Rất cảm ơn lời khen của em. Thầy sẽ cố gắng trả lời dễ hiểu và tiệm cận Hóa học nhất-trong khả năng hiểu biết giới hạn của mình.
Cám ơn Lâm một lần nữa. Chúc em & gia đình sức khỏe. Mong gặp lại em ở các bài viết khác.
Trân trọng.
Em chào thầy.
Em đang ôn thi chương trình sau đại học, tình cờ biết đến website của thầy. Em đọc các bài viết và câu trả lời của thầy đều rất tâm huyết đúng nghĩa của một nhà giáo dục. Thầy cho em hỏi vì sao Crom có Z=24, cấu hình của Crom là 1s2-1s2-2p6-3s2-3p6-3d5-4s1 mà không phải là 1s2-2s2-2p6-3s2-3p6-3d4-4s2 ạ.
Em cảm ơn thầy ạ.
Chào bạn Thoa. Hân hạnh được gặp và trao đổi thông tin tại đây. Cám ơn Thoa đã đặt câu hỏi.
Bạn có thể đọc bài viết đầy đủ tại đây; hoặc xem câu trả lời bên dưới.
👩🏫👨🏫👩🍳Ở cấp III, các thầy cô nói thế này:
Phân lớp được lấp đầy hoàn toàn hoặc một nửa (bão hòa hoặc bán bão hòa) ổn định hơn (bền hơn) các cấu hình còn lại, tức là cấu hình s2, p6, d10, f14 hoặc s1, p3, d5, f7 📌🍊🍍🍆 bền hơn các cấu hình khác như p4, p5, d6, d9, f5, f4, …
⚛︎Mình đã biết rằng các electron điền vào các orbital (AO) nguyên tử có mức năng lượng từ thấp đến cao; do sống ở mức năng lượng thấp – chúng bền vững hơn. Thứ tự AO có mức năng lượng tăng dần như sau: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < ….
Ở Cr với số Z = 24 theo thứ tự trên thì phải là …4s2 3d4.
Nhưng thực tế thấy …4s1 3d5 ; tức 1e ở mức năng lượng thấp 4s đã di chuyển lên mức năng lượng cao hơn là 3d ; điều này là TRÁI QUY LUẬT CHUNG đối với hầu hết các nguyên tử (nhưng không có gì là ngạc nhiên phải không bạn. Cuộc sống quanh ta cũng thấy điều này rất bình thường phải không nào, có nhiều thứ trong cuộc sống cũng không tuân theo những quy luật chung phổ biến mà).
⚛︎Nếu đã dạy HS điều lưu ý 📌🍊🍍🍆 trên thì mình dễ dàng trả lời👇
Cấu hình …3d4 4s2 chỉ ổn định (bền) ở 1 phân lớp 4s; trong khi …3d5 4s1 lại ổn định (bền) ở cả 2 phân lớp 3d và 4s; và như thế… đương nhiên cấu hình Cr là vậy rồi.
Câu trả lời đến đây là chấm dứt và dễ như ăn kẹo.
⚛︎Nhưng nếu HS hỏi tiếp …tại sao? …tại sao? …tại sao hả? thì T chỉ trả lời bằng cách ví von – mà tất cả HS đều dễ dàng chấp nhận; như vầy nè:
Các electron sinh sống trong …5 orbital 3d (5 căn nhà loại 3d) và …1 orbital 4s (1 căn nhà loại 4s) như sau:
……3d4 4s2 là 3d4: | ↑ | ↑ | ↑ | ↑ | | và 4s2 | ⇅ | mình thấy có 1 căn nhà trống ở 3d trong khi căn nhà 4s lại có đến 2 electron ở – chật chội khó chịu quá đi!
……3d5 4s1 là 3d5: | ↑ | ↑ | ↑ | ↑ | ↑ | và 4s1 | ↑ | mình thấy mỗi căn nhà chỉ có 1 electron sinh sống – quá rộng rãi và dễ chịu!
và như vậy, cấu hình …3d5 4s1 bền hơn là đương nhiên (thấy sao mà electron giống y hệt con người mình luôn).
⚛︎Nhưng nếu HS vẫn không chấp nhận câu trả lời ngây ngô trên….
…thì thôi, thầy cô cũng bí luôn!. Và thực tế là, gần 20 năm dạy Hóa, T cũng chẳng khi nào tìm hiểu thêm, vì đã đủ, chẳng HS nào hỏi tiếp; bởi vì cũng như các em bé, chúng mình đang vui vẻ và chấp nhận khái niệm “Gà mà không gáy là con gà con. Gà mà biết gáy là con gà cha”, chứ chưa đi đến tận cùng về cấu tạo cơ thể, đặc tính, … của gà con; gà ba là thế nào – vì thực tế, sự hiểu biết này chỉ dành cho các nhà chuyên môn nghiên cứu về gà thôi.
⚛︎Tương tự, Cu với số Z = 29, được cho là có cấu hình electron …3d9 4s2. Nhưng cấu hình thực tế lại là …3d10 4s1. Bằng cách di chuyển một electron từ 4s sang 3d. Cách giải thích kiểu ví von trên hơi khó rồi nha-chắc phải lách bằng cách dùng khái niệm “cặp đôi” hay 1 kiểu gì đó!.
😁🥴😏Nói dài dòng như vậy để bạn Thoa, nếu cần câu trả lời đến tận cùng, thì phải tìm hiểu thêm lời giải thích bằng “Cơ học (Hóa học) lượng tử” – môn học khiến sinh viên đau khổ quằn quại, thậm chí bị ám ảnh ngay trong những giấc mơ!
⚛︎Khái niệm cấu hình lấp đầy một nửa và lấp đầy hoàn toàn sẽ ổn định hơn có liên quan đến năng lượng trao đổi, một khái niệm trong cơ học lượng tử (the exchange energy, a concept in quantum mechanics).
Năng lượng trao đổi liên quan đến sự đổi chỗ của các hạt giống hệt nhau – trường hợp này là các electron trong nguyên tử.
⚛︎Khi hai hoặc nhiều electron có cùng spin thay đổi vị trí giữa các AO – chúng sẽ giải phóng năng lượng. Sau khi mất bớt năng lượng, các electron chỉ còn mức năng lượng thấp …nên ổn định (bền) hơn so với lúc đầu.
⚛︎Thấy electron cũng giống mình, nếu được bố mẹ đổi chỗ cho ra riêng 1 căn nhà, không sống chung với người khác… thì mình sẽ giải phóng rất nhiều năng lượng luôn-bằng cách: nhảy nhót, ca hát, cười, yêu đời, yêu người, mang đến nhiều năng lượng tích cực cho người khác (nói cho giống sách vở!), …
⚛︎Trời ơi, ông Giáo sư này giảng về NĂNG LƯỢNG TRAO ĐỔI trên YouTube mà T chẳng hiểu gì, chỉ thấy có duy nhất 01 bình luận đơn sơ_Thanks a lot for these lectures!.
Hoặc có bài viết Exchange Energy của University of California San Diego, nhìn thấy chóng mặt luôn.
Thôi, cứ coi cho oai vậy, để hiểu rằng đôi khi, cũng phải chấp nhận câu giải thích ngây ngô như trên; bởi vì… thật quá khó để đi đến sự hiểu biết tường tận.
🍐🍑🍓Chúc Thoa nhiều sức khỏe để tiếp tục hoàn thiện câu trả lời chương trình ôn thi của mình. Câu trả lời của T cũng tham khảo trên các website nước ngoài; mới chỉ là bước khởi đầu rất nhỏ. Nếu có bài viết hoàn thiện hơn, đừng ngại chia sẻ tại đây Thoa nhé.
Hẹn gặp em tại nhiều bài viết khác.
Trân trọng,
Toan từ W3chem.com.
☘️🐩🌱🍂
Em đọc cmt và có thấy thầy giải thích cho bạn Thoa Nguyen và thầy có nhắc đến một từ là “spin”. Vậy thầy cho em hỏi “spin” mà thầy nhắc đến là gì không ạ. Em xin cảm ơn thầy ạ!
Mến chào Quoc Chau.
Câu hỏi rất hay, phải đọc và suy nghĩ để trả lời sao cho hợp lí nhất. Cám ơn sự kiên nhẫn của Châu rất nhiều.
Bạn có thể đọc bài viết chi tiết hơn tại đây, hoặc đọc phần trả lời bên dưới.
🌎🌳Ở cấp 3, khi nói về spin, T nói thế này:
*Khi trái đất quay quanh mặt trời; bản thân Trái đất cũng tự quay quang trục Bắc – Nam của chính mình từ phía Tây sang phía Đông. Nếu có dịp đến sao Bắc cực Polaris, mình nhìn sẽ thấy Trái Đất quay ngược chiều kim đồng hồ.
*Giống vậy, ngày xưa các nhà khoa học nói electron trong khi chạy lòng vòng quanh hạt nhân; bản thân electron cũng tự quay quanh trục của chính mình – các nhà khoa học (sau vô số nghiên cứu, tính toán đắn đo) gọi hiện tượng electron quay là SPIN (trong tiếng Anh, Spin nghĩa là Quay). Nhưng khác Trái đất, họ nghiên cứu đến rụng tóc👴 và nói ELECTRON QUAY THEO 2 HƯỚNG: hướng của từ trường hoặc hướng ngược lại của từ trường. Các nhà khoa học phải chọn đơn vị cho spin, và sau khi làm này nọ, giải Toán lượng tử tùm la tùm lum… họ biểu diễn SPIN CỦA ELECTRON bằng ký hiệu ms và tính ra hai giá trị là ms = +1/2 (gọi là “spin-UP”, biểu thị bằng một mũi tên hướng lên, ↑) hoặc ms = -1/2 (gọi là “spin-DOWN”, biểu thị bằng một mũi tên hướng xuống, ↓). Có vô số lý thuyết cho điều này, nhưng mặc kệ nó đi!…; vì mình mà tìm hiểu tiếp thì bí luôn – việc này dành cho các nhà Hóa học cấp cao.
🪅🪆Có điều gì vô lí hay không khi nói electron quay?
Theo vật lí cổ điển (dùng các phương trình Toán học bình thường, chỉ đúng cho vật thể bự), điều này hợp lí: vì ELECTRON LÀ HẠT mà, giống quả bóng bi-a, nên… quay quanh trục của nó là có lí. Nhưng theo vật lý hiện đại (khi con người dùng Toán lượng tử – dàng riêng cho thế giới các hạt vật chất vô cùng bé nhỏ, toán này ghê lắm!), người ta phát hiện ra ELECTRON LÀ SÓNG (người ta nói electron thể hiện các tính chất của sóng và hạt) ; vì lý do này, chúng không thể quay tròn như các vật thể thông thường.
🧸🦀Vậy nói electron quay là sao?
*Electron không quay như các vật thể mà chúng ta thấy trong cuộc sống hàng ngày. Chúng hoạt động khác với những thứ quay. Con người không thể quan sát thấy trực tiếp electron quay; nhưng họ đo được một thứ gọi là Momen động lượng (***) của electron.
(***)Momen động lượng: dùng để đo mức độ (giá trị) và phương hướng quay của vật thể so với 1 tâm quay xác định.
*Kết quả họ đưa ra như trên; và họ phải dùng Toán lượng tử để giải quyết (nên họ nói Momen động lượng được lượng tử hóa – gọi là Spin).
Spin có giá trị nhất định và không phải mọi giá trị đều đúng cho tất cả các hạt. Các nhà khoa học tính toán ra rằng:
– Electron và Quark (những hạt vật chất) có spin +1/2 hoặc – 1/2.
– Photon (hạt ánh sáng) có spin +1 hoặc – 1.
– Boson Higgs có spin bằng 0.
Vậy việc tưởng tượng electron như một vật thể quay là sai lầm. Thay vào đó, các nhà khoa học đã học cách chấp nhận thực tế quan sát được rằng electron bị lệch hướng bởi từ trường. Tuy nhiên, người ta vẫn dùng thuật ngữ “spin” do có tính lịch sử.
🔍⚗️Thực nghiệm chứng tỏ electron “quay”
*Thí nghiệm Stern và Gerlach là cách quan sát được spin của electron. Năm 1920, Otto Stern và Walter Gerlach thiết kế thí nghiệm táo bạo, họ nung kim loại bạc trong lò cho bốc hơi; dẫn chùm hơi các nguyên tử Ag đi qua từ trường; họ thấy nó bị tách thành hai chùm riêng biệt.
*Vật lý cổ điển nói rằng hạt mang điện tích khi quay sẽ tạo ra từ trường. Vì vậy họ kết luận rằng electron phải quay được. Khi 2 electron có spin đối diện được đặt cạnh nhau, sẽ không có từ trường – vì các spin dương (+1/2) và âm (-1/2) triệt tiêu lẫn nhau. Nguyên tử bạc được sử dụng trong thí nghiệm có tổng cộng 47 electron, 23 loại spin cùng loại và 24 loại spin đối diện. Vì các electron có cùng spin triệt tiêu lẫn nhau, nên một electron không ghép đôi trong nguyên tử sẽ tạo ra từ trường; và vì vậy khi dòng electron đi qua từ trường, chúng sẽ bị tách thành hai chùm tia.
🤦♂️🪴Đọc hết bài sẽ thấy rối thêm; thôi… mình cứ nói đơn giản, SPIN thể hiện một thuộc tính vốn có của electron: khả năng “quay” theo chiều của từ trường hoặc ngược lại; nói đúng hơn, khả năng electron bị lệch khi đi qua từ trường!.
Rất cám ơn câu hỏi của Quoc Chau. Nhờ vậy mà T có dịp tìm hiểu, để biết thêm thế giới vật chất phức tạp ngoài sức tưởng tượng của mình.
Chúc bạn sức khỏe và thành công trong cuộc sống.
Trân trọng,
Toan từ W3chem.com.
Dạ em chào thầy ạ, cho em hỏi là tại sao cấu hình e của La (Z=57) thì electron sẽ điền vào phân lớp 5d trước 4f vậy ạ? Em cảm ơn thầy nhiều lắm ạ.
Chào bạn Đông,
🐸Ta đã biết, các electron được xếp theo mức năng lượng tăng dần như sau:
1s2 < 2s2 < 2p6 < 3s2 < 3p6 < 4s2 < 3d10 < 4p6 < 5s2 < 4d10 < 5p6 < 6s2 < 4f14 < 5d10 <....(****)
🌳Với La có 57 electron, dựa vào dãy trên ta viết được
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f1 ⇒ cấu hình [Xe] 4f1 6s2
⇝⇝⇝Nhưng vì sao, cấu hình electron đúng là:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 ⇒ cấu hình [Xe] 5d1 6s2
Tức 1 electron cuối cùng không đứng ở mức năng lượng thấp 4f theo dãy (****); mà nhảy lên mức năng lượng 5d cao hơn?
😲Có nhiều câu trả lời của các Giảng viên trên Internet. Nếu muốn bớt đau đầu, mình chấp nhận vài câu trả lời đơn giản này:
…đây là một trong những ngoại lệ đối với thứ tự lấp đầy của orbital!… hoặc
…các trường hợp ngoại lệ luôn đưa electron về trạng thái năng lượng thấp nhất có thể, đó là nơi chúng muốn đến… hoặc
…mình nhớ rằng nguyên tử luôn làm mọi thứ cần thiết để trở nên ổn định. Khi 1 electron chuyển qua 5d, nó sẽ cung cấp cho nguyên tử ít phân lớp chưa lấp đầy hơn (còn 4 phân lớp trống thay vì 6 phân lớp trống nếu electron ở 4f); và do đó có tính ổn định cao nhất.
😵💫T cũng đọc nhiều câu trả lời và lí thuyết liên quan, để đưa ra giải thích có thể là hợp lí dưới đây:
Các nhà khoa học đã tính toán để kết luận: 5d và 4f có năng lượng rất gần nhau.
Khi 1 electron ở 4f chuyển sang 5d, …electron đó sẽ giải phóng bớt năng lượng; năng lượng giải phóng ra nhiều đến nỗi …nhiều hơn sự chênh lệch năng lượng giữa 4f và 5d – tức electron chuyển sang mức năng lượng thấp nếu nó ở 5d, điều này khiến electron trở nên ổn định (bền vững) hơn. (Năng lượng giải phóng khi trao đổi electron từ orbital này sang orbital khác_Đông hãy xem câu trả lời của T cho bạn Thoa Nguyen bên trên nha).
🍀🍂🌾🪴Bạn Đông tham khảo câu trả lời trên của T; nếu tìm được lời giải thích khác thuyết phục hơn, Đông hãy ghi lên đây để nhiều người cùng biết nha.
Trân trọng & chúc Đông nhiều sức khỏe,
Toan từ w3chem.com.
Dạ cho em hỏi một câu ngoài lề ạ, vì sao trong nguyên tử, hạt nhân mang điện tích dương, electron mang đt âm ( trị số bằng nhau ),nhưng electron và hạt nhân lại không hút nhau ( không dính vào nhau, electron vẫn di chuyển được).
Em từng nghĩ là do gia tốc cực lớn nhưng electron di chuyển không theo một quỹ đạo duy nhất và xác định nên cũng bác bỏ giả thuyết này ạ.
Hy vọng nhận được câu trả lời từ thầy ạ.
Chào bạn Huyền Phương,
Câu hỏi qúa hay nên rất khó trả lời. Cảm ơn câu hỏi và sự kiên nhẫn của bạn.
Mình nắm ý chính này: Muốn electron không dính vào hạt nhân, thì bản thân electron phải luôn CÓ NĂNG LƯỢNG (động năng electron rất lớn do nó chuyển động quá nhanh) ĐỂ CHẠY, và… đảm bảo rằng năng lượng này KHÔNG ĐƯỢC MẤT ĐI. Điều này giống chúng ta phải không – nếu lúc nào mình cũng no bụng (đủ năng lượng), thì mình cứ chạy nhảy khắp nơi – liên tục không dừng; chỉ khi đói bụng (năng lượng mất dần) thì mình mới dừng chạy và rơi vào căn phòng trong mái nhà thân yêu (~ tựa hạt nhân) nằm im lìm… !!!!
🍏🍏Chúng ta hãy bắt đầu từ đầu. Con người đã nghiên cứu về thế giới vật chất theo thứ tự:
1) Theo vật lý cổ điển (dùng Toán học đời cũ).
2) Theo vật lý lượng tử (dùng Toán học đời mới!, gọi là Toán lượng tử).
***Nói cách dễ hiểu, vật lý cổ điển dùng đúng cho các vật thể vĩ mô (vật thể to, bự, lớn…); và trực giác của chúng ta thường đưa ra câu trả lời đúng cho các vấn đề. Ví dụ: nếu một người thả một tảng đá nặng từ lầu 4 xuống đất, người đó mong đợi rằng tảng đá này sẽ rơi thẳng đứng & đúng điểm tiếp đất dự tính. Theo vật lý cổ điển thì đúng như vậy. Đây là những gì chúng ta thấy trong cuộc sống hàng ngày; trực giác có tác dụng.
***Tuy nhiên, trong thế giới vật lý lượng tử – dùng cho thế giới vi mô (hạt vô cùng nhỏ), trực giác của chúng ta thường sai, bởi vì nhiều dự đoán mâu thuẫn với kinh nghiệm sống hàng ngày của chúng ta. Ví dụ (cho vui thôi) nếu mình thả một sợi lông gà từ trên tầng 4 xuống; thì không còn đúng nữa, ..rằng sợi lông đó sẽ rơi hẳn xuống đất, …nó di chuyển theo đường thẳng đứng như cục đá ở trên; và thậm chí một khả năng lớn là… sợi lông đó sẽ theo gió bay mất tiêu luôn – không xác định được điểm tiếp đất của nó ở đâu nữa. Vậy khi này, trực giác áp dụng cho tảng đá không còn đúng cho sợi lông gà này nữa rồi!.
🍍🍍Theo VẬT LÝ CỔ ĐIỂN, nguyên tử không thể tồn tại do electron rơi tõm vào hạt nhân!
Nếu ta có một hạt nhân dương và một electron âm đứng yên, mọi người đều biết rằng hạt nhân sẽ hút electron. Electron bắt đầu di chuyển về phía hạt nhân cho đến khi nó rơi bõm vào hạt nhân. Đây không thể là mô hình cho một nguyên tử vì nếu vậy… chẳng có nguyên tử nào tồn tại!.
Vậy, chắc chắn 100% là các electron không thể treo lơ lửng phía trên hay phía dưới hạt nhân; Electron không thể đứng yên, chúng phải di chuyển.
***Người ta nghĩ tới electron chuyển động kiểu gì?
Vâng, electron chuyển động tròn, giống như các hành tinh quay quanh mặt trời. Chuyển động tròn này bảo vệ các hành tinh khỏi rơi vào Mặt trời. Vì vậy, người ta nghĩ điều này cũng có tác dụng với electron. Ban đầu nó có vẻ có lý, vì electron chuyển động rất nhanh – điều khiến nó có động năng rất lớn; trong khi thế nằng của nó rất nhỏ (vì khoảng cách electron – hạt nhân rất bé) nên nó không thể dính vào hạt nhân được.
***Nhưng… điều này cũng không có tác dụng với electron! Tại sao?
Vật lý cổ điển dạy chúng ta rằng nếu một vật tích điện chuyển động với gia tốc thay đổi (độ lớn vận tốc hoặc hướng đi của nó thay đổi) theo thời gian, vật này sẽ phát ra sóng điện từ – tức phát ra năng lượng !!!!.
Vì vậy, nếu một electron (một vật tích điện) khi chuyển động tròn xung quanh hạt nhân, hướng của nó sẽ thay đổi, do đó nó sẽ bức xạ năng lượng – electron mất năng lượng từ từ (cho dù nó có động năng rất lớn cũng chẳng đáng kể!); nó sẽ chuyển động xoắn ốc dần xuống hạt nhân. Điều này thật không hợp lý, vì nếu vậy, nguyên tử cũng sẽ sụp đổ hoàn toàn – đồng nghĩa với việc không tồn tại thế giới này!. Nhưng thực tế nguyên tử bền vững và vẫn tồn tại theo thời gian?.
Vật lý cổ điển không thể đưa ra câu trả lời; những câu hỏi như trên đã thúc đẩy sự phát triển của Cơ học lượng tử (Quantum Mechanics), rồi áp dụng vào Hóa học và gọi là Hóa học lượng tử..
🍅🍅VẬT LÝ LƯỢNG TỬ
Đầu tiên, dựa trên quan sát, các nhà vật lý giả định các electron chỉ được phép di chuyển xung quanh hạt nhân trên một số quỹ đạo xác định – gọi là quỹ đạo Sommerfeld. Nếu vậy, các electron không bức xạ!!!!. Các electron chỉ bức xạ khi nhảy từ quỹ đạo này sang quỹ đạo khác.
Họ không biết tại sao, nhưng tiên đề này có vẻ hiệu quả. Kết quả phù hợp tốt với thí nghiệm đối với các nguyên tử rất đơn giản (nguyên tử có một electron, H). Nhưng đối với các trường hợp nguyên tử nhiều electron, thì nó không hiệu quả!
Giải pháp thực sự đã xuất hiện khi con người nghiên cứu ra Cơ học lượng tử. Môn này thì ghê lắm, T đã học thời đại học, nhưng chẳng còn hiểu biết tí gì về Hóa lượng tử. Các kết quả nghiên cứu của nhiều nhà khoa học có liên quan đến câu hỏi của Phương như sau:
1) Electron không chuyển động trên qũy đạo có hình dạng xác định; mà nó chuyển động lung tung không có đường đi xác định – nhưng electron bị giới hạn chạy trong khoảng không gian có hình hài xác định, gọi là orbital nguyên tử (AO).
2) Khi một electron nằm trong trường điện của hạt nhân, electron chỉ chiếm một số mức năng lượng nhất định. 🫒🫖🥮🥦🏃Khi nó nằm trên một trong những mức năng lượng này, nó KHÔNG BỨC XẠ – KHÔNG MẤT NĂNG LƯỢNG. Điều này đã trả lời vì sao electron không dính vào hạt nhân, vì nó vẫn còn đầy đủ năng lượng để chạy nhảy!.
3) Các electron có thể thay đổi giữa các mức năng lượng; nhưng muốn vậy, chúng phải hấp thụ hoặc phát ra một lượng tử năng lượng.
***Electron có rơi vào hạt nhân theo vật lý lượng tử không?
Orbital (AO) là vùng không gian bao quanh hạt nhân, trong khoảng không gian có hạt nhân đó, electron chạy lòng vòng chồng chéo lên cả hạt nhân – tức chắc chắn ở một khoảnh khắc nào đó, Electron sẽ nằm hẳn trong hạt nhân – nhưng như trẻn đã giải thích, do nó vẫn có đầy đủ năng lượng, nên nó lại bung ra tiếp tục chạy.
***Nếu vậy, electron có phản ứng với hạt p trong hạt nhân không?
Electron phản ứng được với p, quá trình này gọi là “bắt electron – Electron capture” và đây là một quá trình phân rã phóng xạ. Trong quá trình bắt electron, một electron ở lớp sát hạt nhân (K, L) bị bị kéo vào bên trong hạt nhân và kết hợp với một proton để tạo thành một neutron:
e + p → n + bức xạ
Electron biến mất và trở thành một neutron mới. Vì nguyên tử hiện có ít hơn một proton, nên “bắt electron” sẽ biến một nguyên tố này thành một nguyên tố khác. Ví dụ:
92U + e → 91Pa + bức xạ
***Bắt electron cần điều kiện gì?
1) Electron phải vượt qua một số rào cản năng lượng do lực đẩy của các electron khác.
2) Một electron chỉ phản ứng với một proton nếu có nhiều proton trong hạt nhân. Khi có quá nhiều proton, một số proton bên ngoài bị liên kết lỏng lẻo và tự do hơn để phản ứng với electron. Nhưng hầu hết các nguyên tử không có quá nhiều proton, vì vậy không có gì để electron tương tác. Kết quả là, mỗi electron trong một nguyên tử ổn định vẫn chạy nhảy tung tăng. Đây cũng là một điều tốt, bởi vì nếu quá trình bắt electron phổ biến, vật chất không ổn định mà sẽ bị sụp đổ.
3) Và còn các điều kiện khác mà các nhà khoa học đã nghiên cứu ra, khó lắm; nên thôi mình cho qua để khỏi nhức đầu nhe.
🥭🍏Câu trả lời trên T đã tham khảo nhiều giải đáp trên Internet. Đặc biệt câu trả lời từ Fermilab – Phòng thí nghiệm vật lý hạt và máy gia tốc hàng đầu Hoa Kỳ.
T hy vọng câu hỏi của Phương đã được giải đáp. Nếu không, đừng ngần ngại viết thư cho T và T sẽ cố gắng hết sức.
Cảm ơn Phương đã để lại câu hỏi. Chúc bạn sức khỏe và gặp nhiều niềm vui, thành công trong cuộc sống.
Trân trọng,
Toan từ W3chem.com.