Tính chất hóa học cơ bản, dự đoán từ số e lớp ngoài cùng
Nhìn vẻ bề ngoài, bạn có thể dự đoán vài tính cách của người ấy, điều này đôi khi sai. Cũng như bạn mèo, khi nhìn tủ lạnh màu hồng, mèo dự đoán …có gà nướng siêu to khổng lồ, nhưng sự thật là …

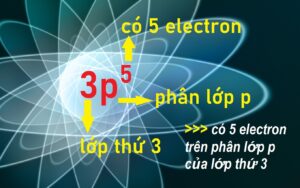
Tính chất hóa học cơ bản của một nguyên tố được các nhà hóa học xác nhận phụ thuộc chủ yếu vào số electron lớp ngoài cùng. Bạn cần phân biệt số electron ở lớp ngoài cùng # số electron ở phân lớp ngoài cùng nha.
Nội dung bài viết
1. Tính chất hóa học cơ bản của 1 nguyên tố là gì?
- Tính kim loại = tính dễ nhường (cho) electron. Ghi là M → Mn+ + ne
- Tính phi kim = tính dễ nhận electron. Ghi là X + ne → Xn-
- Tính trơ = không cho, cũng không nhận electron ở điều kiện bình thường; cứ trơ ra như đá mà không chịu phản ứng.
2. Dự đoán tính chất hóa học cơ bản từ số electron lớp ngoài cùng
Các nguyên tử đã biết trong tự nhiên có từ 1 electron đến tối đa 8 electron ở lớp ngoài cùng.
Thông thường, nếu lớp ngoài cùng có
- 1e, 2e hoặc 3e: Kim loại.
- 5e, 6e hoặc 7e: Phi kim.
- 8e: Tính trơ; trong tự nhiên thấy các nguyên tố này tồn tại dạng chất khí nên người ta gọi là KHÍ TRƠ; mặt khác lượng khí này trong tự nhiên rất hiếm nên còn gọi là KHÍ HIẾM!
- 4e: có thể là Phi kim (như C, Si); có thể là Kim loại (như Ge, Sn, Pb).
Ngoại lệ
- 1H có 1e lớp ngoài cùng nhưng có tính kim loại và cả tính phi kim.
- 2He có 2e lớp ngoài cùng nhưng là khí hiếm.
- 5B có 3e lớp ngoài cùng nhưng là phi kim.
- Một số kim loại có số electron lớp ngoài cùng lớn hơn 4 như
- Sb, Bi (có 5e lớp ngoài cùng, xem nhóm VA).
- Po (có 6e lớp ngoài cùng, xem nhóm VIA).
3. Thực hành
Ví dụ, em hãy xác định tính chất hóa học cơ bản của nguyên tố:
a) H, He, Li, Na, K, Ca.
| Nguyên tử | Cấu hình electron | Số e lớp ngoài cùng | TCHH cơ bản |
| 1H | 1s1 | 1e | *xem ngoại lệ |
| 2He | 1s2 | 2e | *xem ngoại lệ |
| 3Li | 1s2 2s1 | 1e | Kim loại |
| 11Na | 1s2 2s2 2p6 3s1 | 1e | Kim loại |
| 19K | 1s2 2s2 2p6 3s2 3p6 4s1 | 1e | Kim loại |
| 20Ca | 1s2 2s2 2p6 3s2 3p6 4s2 | 2e | Kim loại |
b) C, N, F, Ne, P, Br.
| Nguyên tử | Cấu hình electron | Số e lớp ngoài cùng | TCHH cơ bản |
| 6C | 1s2 2s2 2p2 | 4 | Phi kim |
| 7N | 1s2 2s2 2p3 | 5 | Phi kim |
| 9F | 1s2 2s2 2p5 | 7 | Phi kim |
| 10Ne | 1s2 2s2 2p6 | 8 | Khí trơ |
| 15P | 1s2 2s2 2p6 3s2 3p3 | 5 | Phi kim |
| 35Br** | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5** Phải XẾP LẠI >1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 | 7 | Phi kim |
c) Sc, V, Fe, Zn.
| Nguyên tử | Dãy mức E tăng dần Cấu hình electron | Số e lớp ngoài cùng | TCHH cơ bản |
| 21Sc | 1s2 2s2 2p6 3s2 3p6 4s2 3d1 >1s2 2s2 2p6 3s2 3p6 3d1 4s2 | 2 | Kim loại |
| 23V | 1s2 2s2 2p6 3s2 3p6 4s2 3d3 >1s2 2s2 2p6 3s2 3p6 3d3 4s2 | 2 | Kim loại |
| 26Fe | 1s2 2s2 2p6 3s2 3p6 4s2 3d6 >1s2 2s2 2p6 3s2 3p6 3d6 4s2 | 2 | Kim loại |
| 30Zn | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 >1s2 2s2 2p6 3s2 3p6 3d10 4s2 | 2 | Kim loại |
d) Cr, Cu.
| Nguyên tử | Dãy mức E tăng dần Cấu hình electron bền | Số electron lớp ngoài cùng | TCHH cơ bản |
| 24Cr | 1s2 2s2 2p6 3s2 3p6 4s2 3d4 >1s2 2s2 2p6 3s2 3p6 3d5 4s1 | 1 | Kim loại |
| 29Cu | 1s2 2s2 2p6 3s2 3p6 4s2 3d9 >1s2 2s2 2p6 3s2 3p6 3d10 4s1 | 1 | Kim loại |
**Ban D không cần quan tâm 2 trường hợp này.
4. Liên kết nhanh
Đọc thêm các bài viết về Nguyên tử và Hóa lớp 10 tại đây.
Đừng quên chia sẻ bài viết lên mạng xã hội để nhiều người cùng học nha bạn.