Biến đổi tuần hoàn vài tính chất theo chu kì, nhóm A
Một số tính chất của nguyên tố biến đổi tuần hoàn theo chu kì và nhóm A. Điều này khiến bạn mèo rất ngạc nhiên!

Biến đổi tuần hoàn tổng kết một số nguyên tắc; giúp bạn chỉ cần dựa vào vị trí nguyên tố trong bảng tuần hoàn; là có thể dự đoán tính chất …và so sánh tính chất với các nguyên tố khác.
Nội dung bài viết
1. Cấu hình electron nguyên tử nguyên tố nhóm A biến đổi tuần hoàn
Nhóm A chứa các nguyên tố s và p với cấu hình electron nguyên tử lớp ngoài cùng là:
- nguyên tố s: …ns1 ; …ns2.
- nguyên tố p: …ns2 np(1→6).
Cầu hình electron nguyên tử của các nguyên tố nhóm A biến đổi tuần hoàn, tức lập đi lập lại cầu hình electron, chỉ khác nhau ở số lớp thôi.
2. Công thức một số hợp chất xét biến đổi tuần hoàn
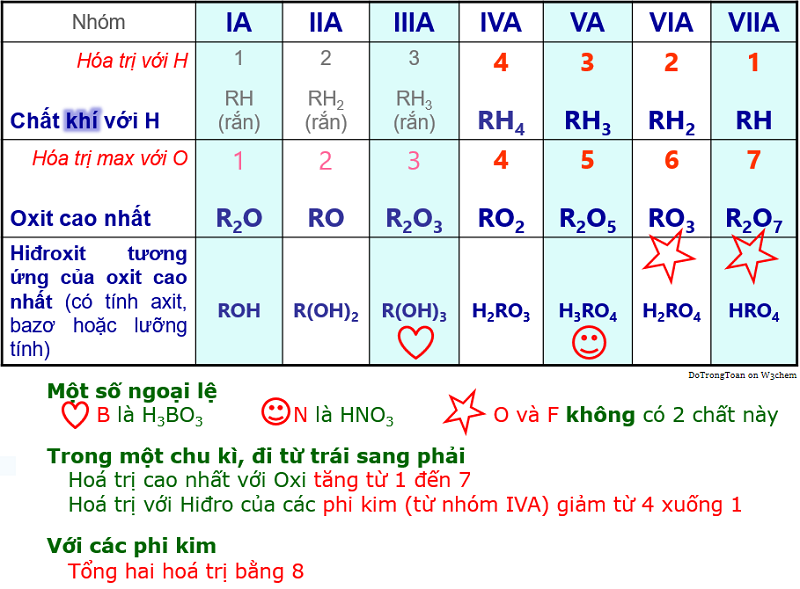
2.1. Công thức oxit cao nhất-hidroxit tương ứng của nguyên tố nhóm IA?
Nhìn vào bảng tuần hoàn để tìm các nguyên tố nhóm IA.
| Nhóm IA | Li | Na | K | Rb | Cs |
| R2O | Li2O | Na2O | K2O | Rb2O | Cs2O |
| ROH | LiOH | NaOH | KOH | RbOH | CsOH |
2.2. Công thức oxit cao nhất-hidroxit tương ứng của nguyên tố nhóm IIA?
| Nhóm IIA | Be | Mg | Ca | Sr | Ba |
| RO | BeO | MgO | CaO | SrO | BaO |
| R(OH)2 | Be(OH)2 | Mg(OH)2 | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 |
2.3. Viết công thức 3 hợp chất trên của các nguyên tố chu kỳ 3?
Nhìn bảng tuần hoàn, thấy chu kì 3 có nguyên tố Na, Mg, Al, Si, P, S, Cl.
| IA Na | IIA Mg | IIIA Al | IVA Si | VA P | VIA S | VIIA Cl |
| / | / | / | SiH4 | PH3 | H2S | HCl |
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
| NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
2.4. Viết công thức 3 hợp chất trên của các nguyên tố chu kỳ 2?
Nhìn bảng tuần hoàn, thấy chu kì 2 có nguyên tố Li, Be, B, C, N, O, F.
| IA Li | IIA Be | IIIA B | IVA C | VA N | VIA O | VIIA F |
| / | / | / | CH4 | NH3 | H2O | HF |
| Li2O | BeO | B2O3 | CO2 | N2O5 | / | / |
| LiOH | Be(OH)2 | H3BO3 | H2CO3 | HNO3 | / | / |
3. Một số tính chất biến đổi tuần hoàn
- Bán kính nguyên tử (R): khoảng cách từ hạt nhân đến lớp vỏ electron (AO) ngoài cùng!
- Nhường nhận electron
- Tính kim loại: nhường electron.
- Tính phi kim: nhận electron.
- Tính trơ: không cho-không nhận electron.
- Nhường nhận ion H+
- Tính acid: cho ion H+ (lớp 11 học).
- Tính base: nhận ion H+ (lớp 11 học).
- Tính lưỡng tính: acid và base (cho và nhận H+).
- Độ âm điện (Đâđ): con số đặc trưng cho khả năng hút (nhận) electron. Đâđ càng lớn ⇔ nhận electron (tức tính phi kim) càng mạnh. Bấm vào đây để tìm hiểu thêm về Đâđ.
- Năng lượng ion hóa thứ nhất (I1): bỏ qua cho lành nha bạn!
4. Quy luật biến đổi tuần hoàn một số tính chất

Bé tập đọc
Trong 1 chu kì, khi đi từ trái sang phải (tức theo chiều điện tích hạt nhân (Z) tăng dần) thì:
- Bán kính nguyên tử, Tính kim loại, Tính base của oxit-hidroxit tương ứng GIẢM DẦN.
- Đâđ, Tính phi kim, Tính acid của oxit-hidroxit tương ứng TĂNG DẦN.
Trong 1 nhóm A, khi đi từ trên xuống dưới (tức theo chiều điện tích hạt nhân (Z) tăng dần) thì:
- Bán kính nguyên tử, Tính kim loại, Tính base của oxit-hidroxit tương ứng TĂNG DẦN.
- Đâđ, Tính phi kim, Tính acid của oxit-hidroxit tương ứng GIẢM DẦN.
| Mẹo vặt nhưng chất lượng! Một số bạn không biết so sánh thế nào là tăng dần, giảm dần; nên thường đặt dấu so sánh sai, rất đáng tiếc. Vậy để đơn giản, bạn chỉ cần lấy các con số để so sánh-rất dễ; rồi đưa dấu so sánh vào bài làm, đảm bảo 100% đúng. Ví dụ +nói tính kim loại tăng dần => lấy số tăng dần 1, 2, 3; đương nhiên 1 < 2 < 3. Lấy dấu so sánh < đưa vào bài làm. +nói tính acid giảm dần => lấy số giảm dần 3, 2, 1; đương nhiên 3 > 2 > 1. Lấy dấu so sánh > đưa vào bài làm. |
5. Thực hành so sánh tính chất có biến đổi tuần hoàn
5.1. So sánh tính base của oxit-hidroxit tương ứng của các nguyên tố nhóm IA?
Nhóm IA xếp theo chiều số Z tăng dần là Li Na K Rb Cs.
Mà trong cùng nhóm A, khi số Z tăng dần, tính base của oxit-hidroxit TĂNG DẦN, vậy
- tính base của oxit Li2O < Na2O < K2O < Rb2O < Cs2O.
- tính base của hidroxit LiOH < NaOH < KOH < RbOH < CsOH.
5.2. So sánh tính acid của oxit-hidroxit tương ứng của các nguyên tố nhóm IVA?
Nhóm IVA xếp theo chiều số Z tăng dần là C Si Ge Sn Pb.
Mà trong cùng nhóm A, khi số Z tăng dần, tính acid của oxit-hidroxit GIẢM DẦN, vậy
- tính acid của oxit CO2 > SiO2 > GeO2 > SnO2 > PbO2.
- tính acid của hidroxit H2CO3 > H2SiO3 > H2GeO3 > H2SnO3 > H2PbO3.
5.3. So sánh tính kim loại và Rnguyên tử của Na, Mg, Al, Si?
Nhìn bảng tuần hoàn, mình thấy các nguyên tố này thuộc CHU KÌ 3; theo chiều số Z tăng dần là Na, Mg, Al, Si.
Mà trong cùng chu kì, khi số Z tăng dần,
- tính kim loại giảm dần => tính KL của Na > Mg > Al > Si.
- R giảm dần => RNa > RMg > RAl > RSi.
5.4. So sánh tính phi kim và Rnguyên tử của F, Cl, Br, I, At?
Nhìn bảng tuần hoàn, mình thấy các nguyên tố này thuộc NHÓM VIIA; theo chiều số Z tăng dần là F, Cl, Br, I, At.
Mà trong cùng nhóm A, khi số Z tăng dần,
- tính phi kim giảm dần => tính PK của F > Cl > Br > I > At.
- R tăng dần => RF < RCl < RBr < RI < RAt.
5.5. So sánh Rnguyên tử của Al, Na, Cl, F, P?
Nhìn bảng tuần hoàn, mình thấy:
+Các nguyên tố thuộc chu kì 3 ; theo chiều số Z tăng dần là 11Na 13Al 15P 17Cl.
Mà trong cùng chu kì, khi số Z tăng dần, R giảm dần => RNa > RAl > RP > RCl.
+Các nguyên tố thuộc nhóm VIIA ; theo chiều số Z tăng dần là 9F 17Cl.
Mà trong cùng nhóm A, khi số Z tăng dần, R tăng dần => RF < RCl.
+Vậy nối 2 kết quả lại, ta có RNa > RAl > RP > RCl > RF.
6. Liên kết nhanh
Đọc thêm các bài viết về Bảng tuần hoàn và Hóa lớp 10 tại đây.
Đừng quên chia sẻ bài viết lên mạng xã hội để nhiều người cùng học nha bạn.






Đi từ trái sang phải bán kính nguyên tử giảm dần. Từ trên xuống dưới bán kính nguyên tử tăng dần => Na>Al>P>Cl>F
Nhìn bảng tuần hoàn ta thấy các nguyên tố đi từ trái sang phải
=> R nguyên tử giảm dần
Và đi từ trên xuống dưới
=> R nguyên tử tăng dần
=> Na> Al> P> Cl> F
Na > Al > P > Cl > F
Na>Al>P>Cl>F
Trong cùng 1 nhóm (theo chiều Z+ tăng), R tăng: Na>F
Trong cùng 1 chu kì (theo chiều Z+ tăng), R giảm: Na>Al>P>Cl
Vậy so sánh R: Na>Al>P>Cl>F
R nguyên tử giảm dần từ trái sang phải nên Na > Al > P > Cl > F
Na>Al>P>Cl>F
Trong cùng 1 chu kì, bán kính nguyên tử giảm khi đi từ trái sang phải. Vì vậy, đối với 4 trong 5 nguyên tử trên, bán kính nguyên tử giảm dần theo thứ tự: Na, Al, P, Cl. Trong cùng 1 nhóm, bán kính nguyên tử tăng theo số thứ tự của chu kì nên bán kính nguyên tử của F nhỏ hơn bán kính của Cl. Tóm lại, từ trên xuống dưới bán kính nguyên tử tăng dần => Na > Al > P > Cl > F
Cl, ta có Z=17
=>Cấu hình electron là: 1s2 2s2 2p6 3s2 3p5
=> Có 3 lớp electron
Al có Z=13
=>Cấu hình electron là: 1s2 2s2 2p6 3s2 3p1
=> Có 3 lớp electron
Na có Z=11
=> Cấu hình electron là: 1s2 2s2 2p6 3s1
=> Có 3 lớp electron
P có Z=15
Cấu hình electron là: 1s2 2s2 2p6 3s1 3p4
Có 3 lớp electron
F có Z=9
Cấu hình electron là: 1s2 2s2 2p5
Có 2 lớp electron
Cl>P>Al>Na>F
– Nguyên tố đi từ trái sang phải => R nguyên tử giảm dần
– Nguyên tố đi từ trên xuống => R nguyên tử tăng dần
=> Na > Al > P > Cl > F
theo chu kì đi từ trái sang phải thì R giảm dần , theo nhóm từ trên xuống R tăng dần => Na > Al > P > Cl > F
Trong cùng một chu kì, bán kính nguyên tử giảm khi đi từ trái sang phải. Bán kính nguyên tử giảm dần theo thứ tự Na>Al>P>Cl>F.
F<Cl<P<Al<Na
R nguyên tử giảm dần đi từ trái sang phải và tăng dần đi từ trên xuống nên
Na > Al > P > Cl > F
Ta có:
– Chu kì 2: 9F
– Chu kì 3: 11Na 13Al 15P 17Cl
Theo chiều từ trên xuống dưới (Từ F đến Na), R tăng dần => Na > F
Theo chiều từ trái sang phải, R giảm => Na > Al > P > Cl
Kết luận: Na > Al > P > Cl > F
Na>Al>P>Cl>F
Theo đề bài :
Các nguyên tử đi từ trái sang phải==> R nguyên tử giảm dần
Các nguyên tử đi từ trên xuống dưới=> R nguyên tử tăng dần
==> Na>Al>P>CL>F
Na < Al < P < Cl < F
Theo chu kỳ từ trái sang phải thì R giảm dần
Theo chu kỳ từ trên xuống R tăng dần
=> Na>Al>P>Cl>F
So sánh bán kính nguyên tử của 17Cl 13Al 11Na 15P 9F
Cùng chu kỳ thì bán kính nguyên tử tăng dần là Cl<P<A<Na
Cùng nhóm thì bán kính nguyên tử tăng dần là FBán kính nguyên tử tăng dần là F<Cl<P<Al<Na
F<Cl<P<Al<Na
So sánh bán kính nguyên tử R theo thứ tự giảm dần : ( số Z càng tăng thì R càng nhỏ ):
F(Z=9);Na(Z=11):Al(Z=13);:P(Z=15);Cl(Z=17)
=> RF>RNa>RAl>RP>RCl
Na > Al > P > Cl > F
thầy ơi con trl lại, bài nãy con type lộn
so sánh bánh kính nguyên tử R giảm dần:
RF(Z=9) > RNa(Z=11) > RAl(Z=13) > RP(Z=15) > RCl(Z=17)
Trong cùng một nhóm, bán kính nguyên tử tăng theo số thứ tự của chu kì nên bán kính nguyên tử giảm dần theo chiều từ trái sang phải: Na>Al>P>Cl>F
So sánh bán kính nguyên tử (R) của 17Cl, 13Al, 11Na, 15P, 9F
Nhìn bảng tuần hoàn, ta thấy các nguyên tố này thuộc CHU KÌ 3; theo chiều số Z tăng dần 11Na, 13Al, 15P 17Cl
Mà trong cùng chu kì, khi số Z tăng dần:
+ R giảm dần => RNa > RAl > RP > RCl
Nhìn bảng tuần hoàn, ta thấy các nguyên tố này thuộc NHÓM VIIA; theo chiều số Z tăng dần là 9F, 17Cl
Mà trong cùng nhóm A, khi số Z tăng dần:
+ R tăng dần => RF < RCl
Ta có RCl < RP, mà RF RNa > RAl > RP > RCl > RF
Bán kính nguyên tử theo chiều trái sang phải thì giảm dần
Từ trên xuống dưới thì tăng dần nên ta có:
Na < Al < P < Cl < F
R nguyên tử giảm dần đi từ trái sang phải và tăng dần đi từ trên xuống => Na>Al>P>Cl>F
vì trong một chu kỳ, bán kính nguyên tử giảm đi khi đi từ trái sang phài
Có R nguyên tử giảm dần từ trái sang phải và tăng dần từ trên xuống
=> Na > Al > P > Cl > F
Theo chu kì giảm dần từ trái sán phải, tăng dần từ trên xuống
=> Na>Al>P>Cl>F
Trong cùng 1 nhóm (theo chiều Z+ tăng), R tăng: Na>F
Trong cùng 1 chu kì (theo chiều Z+ tăng), R giảm: Na>Al>P>Cl
Vậy so sánh R: Na>Al>P>Cl>F
Ta có R nguyên tử giảm dần từ trái sang phải
=> Bán kính nguyên tử giảm dần theo thứ tự là: Na>Al>P>Cl>F
Na<Al<P<Cl<F
bán kính nguyên tử tăng dần
Cùng nhóm A : Cl > F
cùng chu kì : Na > Al > P > Cl
Theo chu kì từ trái sang phải thì R giảm dần
Theo nhóm A từ trên xuống dưới R tăng dần
=> Na > Al > P > Cl > F
Theo 1 chu kì , 11Na ,13Al , 11 Na,15P, 17Cl
Mà 1 chu kì , R giảm dần
R của Na , Al , P , Cl
=>R của Na>Al>P>Cl
Theo nhóm VIIA có 9F 17Cl
Mà 1 nhóm A thì R tăng dần
=> R của FAl>P>Cl>F