Phản ứng oxi hóa khử là gì? Hướng dẫn cân bằng
Ai …phản ứng oxi hóa khử đây. Ai ….phản ứng oxi hóa khử hông? Tiếng rao lạc lõng …chơi vơi như giấc mơ trưa hè …rồi mất hút. Rất ít người ra mua, có lẽ …đây không phải là hàng thiết yếu!

Nội dung bài viết
1. Định nghĩa phản ứng oxi hóa khử
1.1. Phản ứng oxi hóa khử là gì?
Phản ứng oxi hóa khử là phản ứng có sự cho – nhận electron ⇔ phản ứng có sự thay đổi (tăng – giảm) số oxi hóa.
Tên chất và tên quá trình xảy ra sự cho nhận electron như bảng sau:

Để dễ nhớ, mọi người thường lẩm bẩm các câu sau:
- Khử cho O nhận ; hoặc Khử tăng O giảm.
- Chất khử còn gọi là Chất bị oxi hóa.
- Chất oxi hóa còn gọi là Chất bị khử.
1.2. Thực hành với một phản ứng oxi hóa khử cụ thể
Mình lấy 1 phản ứng oxi hóa khử đã học ở bài Số oxi hóa là:

Vì sao đây là phản ứng oxi hóa khử?
Vì có sự thay đổi số oxi hóa, trong đó:
- Nguyên tố Cu từ soh 0 tăng lên +2
- Nguyên tố N từ soh +5 giảm xuống +2
Hãy xác định chất oxi hóa, chất khử?
- Cu0 (hoặc Cu) là chất khử do soh tăng
- N+5 (hoặc HNO3) là chất oxi hóa do soh giảm
Hãy viết quá trình oxi hóa, quá trình khử?
- Quá trình oxi hóa: Cu0 → Cu+2 + 2e
- Quá trình khử: N+5 + 3e → N+2
Lưu ý cách ghi số oxi hóa như trên là SAI đó nha! Ghi theo sẽ bị trừ điểm. Em có biết sai chỗ nào không? Xem lại tại đây nếu quên!
2. Cân bằng theo phương pháp thăng bằng electron
Với những phản ứng oxi hóa khử thông thường, dễ thương; mình tiến hành theo 5 bước. Với phản ứng phức tạp, mình cần rèn luyện công phu theo thời gian.
2.1. Gồm 5 bước như sau
1. Viết các soh thay đổi.
2. Viết phương trình cho – nhận electron (viết bán phản ứng). Bạn tính số electron cho – nhận = soh lớn – soh nhỏ.
3. Nhân thêm số sao cho số e cho = số e nhận (thăng bằng e).
4. Đưa hệ số vào phương trình rồi cân bằng nguyên tố theo thứ tự: Kim loại ⇒ Phi kim (Cl, S, N, P, C, … ; nhớ không cân bằng Oxi) ⇒ đến H.
5. Đếm lại O để kiểm tra.
2.2. Ví dụ vài phản ứng
Phản ứng dưới đây là dạng rất phổ biến mà mình gặp hoài. Còn có nhiều dạng rất phức tạp, bạn cứ từ từ thưởng thức. Cần nhớ điều quan trọng: bạn phải tập luyện cân bằng từ từ mới thấm; bởi vì cân bằng phản ứng oxi hóa khử là KĨ NĂNG, cần có thời gian rèn luyện, …không phải là bài học thuộc lòng!
Phản ứng Cu + HNO3 → Cu(NO3)2 + NO + H2O


Phản ứng Al + H2SO4 → Al2(SO4)3 + SO2 + H2O
Trong phần hướng dẫn này, mình sẽ học thêm 1 kĩ năng, các bạn chú ý xem là gì nha.


2.3. Vui rèn kĩ năng
1. Các phản ứng oxi hóa khử sau mình sẽ gặp lại ở chương sau:
- Ag + H2SO4 đặc → Ag2SO4 + SO2 + H2O
- Mg + H2SO4 đặc → MgSO4 + SO2 + H2O
- Mg + H2SO4 đặc → MgSO4 + S + H2O
- Mg + H2SO4 đặc → MgSO4 + H2S + H2O
- Al + H2SO4 đặc nóng → Al2(SO4)3 + S + H2O
- Al + H2SO4 đặc nóng → Al2(SO4)3 + H2S + H2O
Chúc mừng bạn đã vượt qua chính mình.

2. Các phản ứng oxi hóa khử sau mình sẽ gặp lại ở lớp 11 và 12.
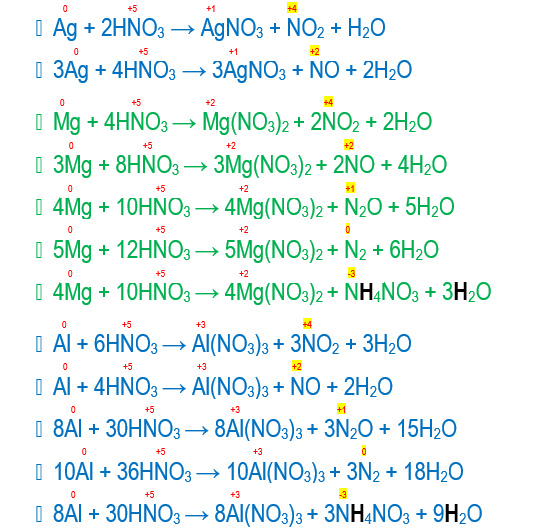
- Ag + HNO3 → AgNO3 + NO2 + H2O
- Ag + HNO3 → AgNO3 + NO + H2O
Cân bằng tiếp các phản ứng oxi hóa khử sau:
- Mg + HNO3 → Mg(NO3)2 + NO2 + H2O
- Mg + HNO3 → Mg(NO3)2 + NO + H2O
- Mg + HNO3 → Mg(NO3)2 + N2O + H2O
- Mg + HNO3 → Mg(NO3)2 + N2 + H2O
- Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
Cân bằng tiếp các phản ứng oxi hóa khử sau:
- Al + HNO3 → Al(NO3)3 + NO2 + H2O
- Al + HNO3 → Al(NO3)3 + NO + H2O
- Al + HNO3 → Al(NO3)3 + N2O + H2O
- Al + HNO3 → Al(NO3)3 + N2 + H2O
- Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O
Chúc mừng bạn đã vượt qua chính mình.
3. Cân bằng loại phản ứng TỰ OXI HÓA KHỬ
Tự oxi hóa khử ⇔ 1 chất vừa là chất oxi hóa, vừa là chất khử luôn!
Phản ứng sau mình sẽ gặp lại trong bài Halogen đó nhe.


4. Cân bằng loại phản ứng NỘI OXI HÓA KHỬ
Nội oxi hóa khử ⇔ chất oxi hóa và chất khử sống trong cùng 1 phân tử!
Dạng này không thông dụng, nhất là ban D. Vậy nên mình cho qua. Nếu có dịp thì tìm hiểu thêm nha bạn.
5. Cân bằng loại phản ứng có NHIỀU SỐ OXI HÓA THAY ĐỔI
Dạng này khá khó. Vậy nên mình để sau vậy. Khi nào có dịp thì tìm hiểu thêm nha bạn.
6. Liên kết nhanh
Đọc thêm các bài viết về Phản ứng oxi hóa-khử và Hóa lớp 10 tại đây.
Viết bởi Đỗ Trọng Toan từ W3chem.com
Mình là người tự thực hiện toàn bộ dự án này – bao gồm xây dựng trang web, viết nội dung, tìm tài liệu tham khảo, trả lời câu hỏi bạn gởi về. Vui lòng xem xét QUYÊN GÓP để hỗ trợ W3chem CHỈ BẰNG CÁCH CHIA SẺ BÀI VIẾT NÀY LÊN MẠNG XÃ HỘI; bởi vì trong tương lai, bạn sẽ cho mình nhiều thời gian để làm việc trên W3chem, cũng có nghĩa bạn nhận thêm nhiều nội dung mới nhanh hơn tại đây.😍 🥰 😘






Dạ em chào thầy ạ, em có một thắc mắc và rất mong được thầy giải đáp ạ.
Khi cân bằng phương trình phản ứng NH4ClO4 → N2↑ + Cl2↑ + O2↑ + H2O↑
thì tại sao trong quá trình oxi hóa 2O(2-) → O2 + 4e phải nhân đôi hệ số, còn quá trình oxi hóa: 2N(-3) → N2 + 6e thì không cần nhân ạ?
Dạ là khi nào mình cần nhân hệ số vào các quá trình và khi nào thì mình không cần ạ?
Em cảm ơn thầy và chúc thầy có thật nhiều sức khỏe và bình an.
Chào bạn Hà Ninh, đến hôm nay T mới gởi câu trả lời, T rất cám ơn sự kiên nhẫn của em.

🐩🐞🐝Cả hai trường hợp trên đều có nhân hệ số đó em, hãy xem
**1O(-2) → 1O + 2e
Vậy nên 2O(-2) → O2 + 2.2e
**1N(-3) → 1N + 3e
Vậy nên 2N(-3) → N2 + 2.3e
🐩🐞🐝Khi nào cần nhân hệ số?
**Trong phương trình trên, mình thấy sau phản ứng tạo thành N2; vậy ban đầu mình cần có 2 Nitơ. Cũng vậy, sau phản ứng tạo O2, nên ban đầu mình cần có 2 Oxi. Nói chung mình thường dựa trên đơn chất (N2, O2, Cl2, …) để nhân hệ số.
***Tuy nhiên, còn tùy trường hợp cụ thể để xem xét. Ví dụ ở loại phản ứng TỰ OXI HÓA KHỬ bên trên, ta thấy
…ban đầu có Cl2 (2 Clo), sau phản ứng thấy 1Cl dùng để tạo Cl(+5), 1Cl dùng để tạo Cl(-1); vậy mình không nhân hệ số. Nếu mình nhân thì sau khi cân bằng ta được
6Cl2 + 12KOH → 2KClO3 + 10KCl + 6H2O
…và như vậy là không đúng, các hệ số cân bằng phải là số nguyên đơn giản nhất. Nên mình lại phải tiếp tục chia 2 để được phương trình đúng là
3Cl2 + 6KOH → KClO3 + 5KCl + 3H2O
🐩🐞🐝Cũng không cần lo lắng quá đâu, vì trong chương trình mình sẽ gặp đi gặp lại vài phương trình, và nếu đã luyên tập thì tự khắc mình nhận ra ngay thôi (còn nếu thi Olympic, HS giỏi hay gì đó thì khỏi bàn rồi!).
☘️🍁Hy vọng câu trả lời đúng phần em hỏi; nếu chưa rõ thì viết tiếp trên đây nha em.
Cảm ơn lời chúc của Hà Ninh. T chúc em cùng gia đình thật nhiều sức khỏe để học tập, làm việc và gặt hái được nhiều thành công trong cuộc sống.
Hẹn gặp em ở các câu hỏi khác.
Trân trọng,
Toan từ W3chem.com.
Em chào thầy,
Em cảm ơn thầy rất nhiều vì đã dành thời gian để giải thích thắc mắc của em cực kì chi tiết và dễ hiểu. Em đã hiểu và nắm được nội dung này rồi ạ. Dù có đợi hơi lâu nhưng em cảm thấy không có vấn đề gì ạ, cực kì xứng đáng và rất vui khi được thấy giải đáp. Em cảm ơn thấy rất luôn nhiều ạ.
Em chúc thầy và gia đình có thật nhiều sức khỏe và bình an.
Dạ em cũng hi vọng có thêm nhiều cơ hội được thầy giải đáp những thắc mắc về Hóa ạ.
Em chào thầy.
Chào Hà Ninh,
T cám ơn nhiều vì em đã gởi câu hỏi cùng lời bình luận hiểu biết và tử tế.
Rất vui được trả lời những câu hỏi em gởi đến W3chem. Mong sớm gặp lại Hà Ninh ở nhiều câu hỏi khác. Chúc em và Gia đình nhiều sức khỏe.
Trân trọng,
Toan từ W3chem.com