Số oxi hóa, hướng dẫn cách tính và áp dụng vào phản ứng
Phim “Trò chơi con mực” mới chiếu 2 tháng, nhưng đã có rất nhiều lời cảnh báo về tác động tiêu cực đến tâm lý giới trẻ. Số oxi hóa lại khác, đã công chiếu n lần; nhưng hoàn toàn chỉ có tác động tích cực thôi! Bạn hãy tập trung năng lượng vào bài học này; thay vì ….

Nội dung bài viết
1. Vì sao nói số oxi hóa là 1 con số giả bộ?
Mình đã học hai loại liên kết hóa học chủ yếu: Liên kết ion; Liên kết cộng hóa trị. Bây giờ khi tính số oxi hóa, người ta giả bộ …tất cả mọi phân tử trên cuộc đời này đều chỉ hoàn toàn 100% là liên kết ion luôn; nghĩa là mọi hạt trong phân tử bất kỳ đều là ion dương hoặc ion âm!
Và như vậy, số oxi hóa đơn giản chính là điện tích của “ION” đó. Vấn đề còn lại chỉ là cách viết khác nhau để phân biệt giữa điện tích với số oxi hóa.
Bạn hãy xem bảng sau; và tự đưa ra nhận xét:
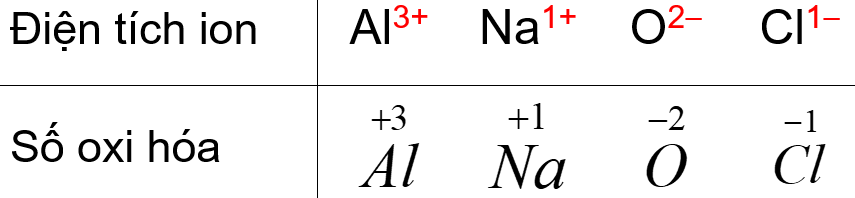
2. Số oxi hóa = Điện tích ion. Dễ quá phải không quý dzị?
2.1. Soh của đơn chất; của hợp chất bằng 0
Vì số oxi hóa bằng điện tích; mà điện tích của đơn chất, hợp chất đương nhiên bằng 0; do vậy điều này là đương nhiên thôi. Ví dụ,
- Soh của đơn chất: kim loại Na, Mg, Al; khí O2, N2, Cl2, …bằng 0.
- Soh của hợp chất: NO, NO2, HNO3, H2SO4, Al(NO3)3, …bằng 0.
2.2. Trong hợp chất, soh của ion đơn nguyên tử = điện tích
Thông dụng
- Ion Li+ Na+ K+ Ag+ là +1
- Ion Be2+ Mg2+ Ca2+ Ba2+ Zn2+ là +2
- Ion Al3+ là +3
- Ion F– là -1 (soh duy nhất của flo)
Chỉ trong hợp chất với H, với Kim loại, với Phi kim có độ âm điện nhỏ hơn thì
- ion Cl– Br– I– là -1
- ion S2- là -2
Oxi trong hợp chất
- thông dụng O2- có soh là -2
- nhưng trong O2F2 là +1 ; trong OF2 là +2 ; trong H2O2 là -1 ; trong KO2 là -1/2
Hydro trong hợp chất
- thông dụng H1+ có soh là +1
- nhưng trong NaH, CaH2 lại là -1
Các kim loại có nhiều số oxi hóa, hay gặp
- Cu+ là +1 ; Cu2+ là +2
- Fe2+ là +2 ; Fe3+ là +3
- Cr2+ là +2 ; Cr3+ là +3 ; Cr6+ là +6
2.3. Trong hợp chất, soh của ion đa nguyên tử = điện tích
- Amoni NH4+ là +1.
- Nitrat NO3– ; Nitrit NO2– ; Perclorat ClO4– ; Clorat ClO3– ; Clorit ClO2– ; Hipoclorir ClO– là -1.
- Sunfat SO42- ; Sunfit SO32- ; Cacbonat CO32- là -2.
- Photphat PO43- là -3.
3. Cách tính số oxi hóa dựa trên các số đã biết
Tính số oxi hóa của một nguyên tố trong phân tử hợp chất hoặc ion đa nguyên tử như sau:

Bạn cũng có thể không cần ghi biểu thức toán như trên; mà mình tính nhẩm trong đầu luôn, rất đẳng cấp!
3.1. Tính số oxi hóa của nguyên tố trong phân tử
- Ví dụ mình hãy tính soh của Nitơ trong phân tử NO, NH3, NO2, N2O, N2O3, N2O4, HNO3, HNO2, NaNO3. Mình đặt số oxi hóa của N là chữ a; số oxi hóa của O, H, Na đã có là -2, +1, +1 (mình tra ở mục trên). Khi đó:
NO | a.1 + (-2).1 = 0 ⇒ a = +2
NH3 | a.1 + (+1).3 = 0 ⇒ a = -3
NO2 | a.1 + (-2).2 = 0 ⇒ a = +4
N2O | a.2 + (-2).1 = 0 ⇒ a = +1
N2O3 | a.2 + (-2).3 = 0 ⇒ a = +3
N2O4 | a.2 + (-2).4 = 0 ⇒ a = +4
HNO3 | (+1).1 +a.1 + (-2).3 = 0 ⇒ a = +5
HNO2 | (+1).1 + a.1 + (-2).2 = 0 ⇒ a = +3
NaNO3 | (+1).1 + a.1 + (-2).3 = 0 ⇒ a = +5
- BT1. Tính soh của lưu huỳnh trong phân tử H2S, SO2, SO3, H2SO3, H2SO4, BaSO4.
- BT2. Tính soh của clo trong phân tử HCl, FeCl2, FeCl3, Cl2O, Cl2O3, Cl2O5, Cl2O7, HClO, HClO2, HClO3, HClO4, KClO3.
- BT3. Tính soh của sắt trong phân tử FeO, Fe2O3, Fe3O4, FeS (coi chừng FeS2).
Chúc mừng bạn đã kiên nhẫn trong bài rèn luyện này.

3.2. Tính số oxi hóa của nguyên tố trong ion
- Ví dụ tính soh của S trong ion SO32- ; SO42- ; HSO3– ; HSO4–. Mình đặt số oxi hóa của S là chữ a; số oxi hóa của O, H đã có là -2, +1 (tra ở mục trên). Khi đó:
SO32- | a.1 + (-2).3 = -2 ⇒ a = +4
SO42- | a.1 + (-2).4 = -2 ⇒ a = +6
HSO3– | (+1).1 + a.1 + (-2).3 = -1 ⇒ a = +4
HSO4– | (+1).1 + a.1 + (-2).4 = -1 ⇒ a = +6
- BT1. Tính soh của N trong ion NO3– ; NO2– ; NH4+ ; trong phân tử NH4NO3 ; NH4NO2.
- BT2. Tính soh của P trong ion PO43- ; HPO42- ; H2PO4–.
Chúc mừng bạn đã kiên nhẫn trong bài rèn luyện này.

4. Vài số oxi hóa hay sai
Bạn hãy dõi theo bảng sau:

5. Phân loại phản ứng dựa trên số oxi hóa
5.1. Ghi soh vào 1 phản ứng cụ thể
- Ghi soh của tất cả nguyên tố trong phản ứng đề cho, ví dụ

- Mình thấy các phản ứng a. b. c. có số oxi hóa thay đổi ⇒ giữ lại các soh đổi; xóa các soh không đổi để đỡ rối con mắt, mình có kết quả nhìn rất gọn đẹp như sau:
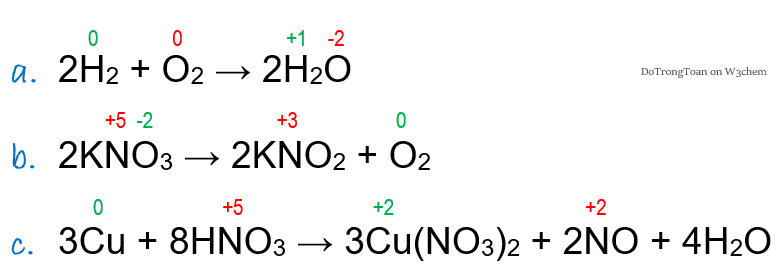
Đương nhiên, bạn dễ dàng thấy ngay: phản ứng d. e. f. có số oxi hóa không đổi; do vậy mình không ghi lại làm gì cho mất công!
5.2. Phân loại phản ứng dựa vào sự thay đổi soh
Dựa trên sự thay đổi soh trước và sau, các phản ứng hóa học được chia thành 2 loại (dễ hơn rất nhiều so với cách phân loại phản ứng lúc ta còn bé – khi học Hóa lớp 8, lớp 9!):
- Phản ứng không có sự thay đổi số oxi hóa, ví dụ phản ứng d, e, f ở trên.
- Phản ứng có sự thay đổi số oxi hóa (ví dụ phản ứng a, b, c ở trên), còn gọi là PHẢN ỨNG OXI HÓA-KHỬ.
Nếu bạn chú ý trong mỗi phản ứng oxi hóa-khử a, b, c đều có số oxi hóa tăng và số oxi hóa giảm.
Để hiểu nhiều hơn về phản ứng oxi hóa-khử; mời bạn đọc câu chuyện ly kì tiếp theo: Ai …phản ứng oxi hóa khử đây.
6. Liên kết nhanh
Đọc thêm các bài viết về Phản ứng oxi hóa-khử và Hóa lớp 10 tại đây.
Viết bởi Đỗ Trọng Toan từ W3chem.com
Mình là người tự thực hiện toàn bộ dự án này – bao gồm xây dựng trang web, viết nội dung, tìm tài liệu tham khảo, trả lời câu hỏi bạn gởi về. Vui lòng xem xét QUYÊN GÓP để hỗ trợ W3chem CHỈ BẰNG CÁCH CHIA SẺ BÀI VIẾT NÀY LÊN MẠNG XÃ HỘI; bởi vì trong tương lai, bạn sẽ cho mình nhiều thời gian để làm việc trên W3chem, cũng có nghĩa bạn nhận thêm nhiều nội dung mới nhanh hơn tại đây.😍 🥰 😘






Thầy ơi số oxi hóa của oxygen là -1/2 trong KO2 chứng tỏ trong KO2 có liên kết ion và K có 19e và đã cho 2 oxygen 1e và lúc này mỗi oxygen nhận 1,5e và do đó số oxi hóa của oxygen là -1/2 đó ạ.
Hình như Hoàng nhầm ở chỗ mỗi Oxygen nhận 0,5e; không phải 1,5e phải không?
KO2 có tên tiếng Anh là Potassium superoxide.
Nếu tìm trên mạng, mình thấy mọi người chỉ đề cập đến cách tính ra số oxi hóa ra -1/2; chứ không thấy mọi người giải thích đề hiểu tường tận (bởi vì việc này có lẽ vô ích chăng? Cũng có thể lắm; bởi vì SỐ OXI HÓA là 1 CON SỐ GIẢ VỜ mà)
Mỗi Oxygen nhận một nửa eletron (0,5e) ư? Sao giống mẹ chia đôi quả cam cho 2 anh em ăn quá! Nhưng mà electron là 1 hạt, hổng thể nào “cắt” ra làm 2 phần để chia cho 2 Oxygen; nhưng mà… mình nhớ SỐ OXI HÓA là giá trị điện tích GIẢ BỘ mà, vậy nên… điều gì cũng có thể xảy ra!
Người ta cũng dùng chữ SỐ OXI HÓA TRUNG BÌNH nữa cơ. Mình nói K có số oxi hóa +1; nên muốn trung hòa điện, số oxi hóa của 2 Oxygen phải là -1 ; viết cho dễ hiểu là [K]+1 [O2]-1. Từ đó số oxi hóa trung bình của 1 Oygen là -1:2; tức -1/2.
Tiếp tục đặt câu hỏi nha Hoàng.
– Đây là câu hỏi của con: hãy giải thích sự hình thành số oxi hóa của Fe và S trong phân tử FeS2.
Dạ thầy có thời gian rãnh thì giúp con với ạ! Chúc thầy năm mới bình an và sức khỏe!
Hồi xưa, khi còn thi tự luận môn Hóa, người ta cũng hay hỏi tính soh kiểu này. Khác với cách tính đơn giản như bài học trên; những bài này mình phải làm 2 bước:
B1_vẽ được công thức cấu tạo đúng (không phải theo hóa trị để vẽ theo ý mình, mà phân tử đó tồn tại thực tế trong TỰ NHIÊN có công thức cấu tạo thế nào?).
B2_dựa trên độ âm điện để xem nguyên tử nào bị rút mất electron (nguyên tử có độ âm điện lớn sẽ rút electron về mình).
Với FeS2
B1_nếu tìm trên google với từ khóa “Structure of FeS2”, mình sẽ thấy vô số bài nghiên cứu về công thức cấu tạo của nó. Nhưng ở phạm vi tính soh, CTCT của FeS2 được vẽ đơn giản như hình đính kèm ở ***.
B2_vì độ âm điện của Fe < S nên S sẽ rút electron của Fe về (nhớ 1 liên kết tương đương 1e như trong bài liên kết cộng hóa trị).
***Bấm vào đây để xem hình nha Hoàng.
Và như vậy: Fe bị mất 2e nên soh là +2; mỗi S nhận 1e nên soh là -1.
Năm mới chúc Hoàng và Gia đình Sức khỏe – Hạnh phúc – Thành công trong học tập và cuộc sống.
Dạ cho con hỏi trong CuFeS2 có những liên kết gì đã được xảy ra ạ?
Mình sẽ thấy người ta không nói về loại liên kết gì hay vẽ CTCT đơn giản của CuFeS2 (xem lại CTCT đơn giản của FeS2); bởi vì cách vẽ này mình dễ hiểu – nhưng lại hoàn toàn không đúng thực tế của chất đó trong tự nhiên (nghĩa là mình đang ba xạo!). Tự tô vẽ ra 1 công thức cấu tạo theo tưởng tượng, theo hóa trị hay theo số oxi hóa là mình đang tự chế; có khi vẽ ra chất chẳng có trong tự nhiên – chẳng ích lợi gì trong khoa học (nhớ HÓA là môn khoa học TỰ NHIÊN).
Cũng như FeS2, người ta nghiên cứu cấu trúc thực tế của nó cơ. Mà quá trình này ghê gớm lắm. Hoàng hãy đánh từ khóa “chemical bonding in CuFeS2” sẽ thấy nhiều bài nghiên cứu khủng, Ví dụ tại trang https://aip.scitation.org/doi/10.1063/1.4947080, lời giới thiệu (dùng google dịch!) đọc xong mình hết muốn gì luôn:
• Hình học, điện tử và từ tính chalcopyrit CuFeS2 đã được nghiên cứu bằng cách sử dụng tính toán lý thuyết hàm mật độ trao đổi lai (???). Các kết quả được so sánh với dữ liệu lý thuyết và thực nghiệm có sẵn…
• Đặc biệt, hành vi của các electron 3d của Fe3+ được thảo luận theo mô hình Hubbard-Anderson trong chế độ tương quan mạnh và được mô tả tương tự trong cả hai nguyên vật liệu bởi lực đẩy Coulomb tại chỗ ( U ) ∼ 8,9 eV và tích phân truyền ( t ) ∼ 0,3 eV (???).
• RM-C. cảm ơn Ministryio de Ciencia e Innovación (Tây Ban Nha) về Hợp đồng Nghiên cứu “Juan de la Cierva”. VH-YC được hỗ trợ thông qua học bổng sinh viên tại Trung tâm Đào tạo Tiến sĩ về Lý thuyết và Mô phỏng Vật liệu tại Đại học Hoàng gia Luân Đôn, được tài trợ bởi Hội đồng Nghiên cứu Khoa học Vật lý và Kỹ thuật (EPSRC) của Vương quốc Anh… Công trình này được hỗ trợ bởi Trung tâm phục hồi khoáng chất tiên tiến Rio Tinto tại Đại học Hoàng gia Luân Đôn. Công trình này đã sử dụng Dịch vụ Siêu máy tính Quốc gia của Vương quốc Anh (https://www.archer2.ac.uk)…
Thôi, vậy thì mình tìm được ở đâu trên Internet người ta nói về loại liên kết hay vẽ CTCT đơn giản của CuFeS2 thì an ủi dùng chơi nha Hoàng. Bởi vì như đã nói, công thức mình tự vẽ ra hoàn toàn chẳng có tác dụng gì trong khoa học; chỉ dùng để ra đề đánh đố cho vui thôi (nhưng thầy cũng chưa kiếm ra CTCT đơn giản của CuFeS2). Đến nay, mới thấy người ta tính các số oxi hóa trong CuFeS2 à; mà các này khó quá nên khi cân bằng, mình ghi số oxi hóa của cả phân tử là 0 luôn để cho dễ.
Thầy cho con hỏi gốc Axit SO4 vì sao S luôn có số oxh là +6, con tưởng chỉ trong ion SO4 2- và H2SO4 mới có S là +6 ?
Chào Minh Phước.
Ở cấp II, gốc axit người ta vẽ =SO4 (có hai cái gạch để ý nói… hóa trị II, không biết sách bây giờ có đổi không?).
Ở lớp 10 cấp III; do đã được học về ION, nên lúc này gốc axit người ta ghi [SO4]2-.
Như vậy, gốc axit SO4 xưa kia – thời ngây ngô cấp II cũng chính là ion [SO4]2- ở cấp III; do vậy mà S luôn có số oxi hóa +6 phải không nào?
Vấn đề là do học cấp II còn nhỏ; nếu nói gốc axit=SO4 là ion [SO4]2- dễ làm các bé bị sốc, nên người ta ghi nhẹ nhàng =SO4 cho an tâm – vì có hai gạch rất dễ hiểu luôn!. Thầy cô lớp 10 đôi khi quên nói cho HS biết gốc acid =SO4 chính là ion [SO4]2-.
Cám ơn câu hỏi của Phước. Chúc em vui học và đừng quên tận hưởng tuổi thanh xuân nha.
Trân trọng.
Dạ thầy cho con hỏi là cách xác định số oxi hoá của FeCl2 ạ, con đã đọc comment ở trên nhưng vẫn chưa hiểu làm sao để vẽ được CTCT để tính số oxi hoá ạ
Con cảm ơn thầy rất nhiều ạ
😵💫À, Phước không cần đọc phần comment; mà phải đọc phần LÍ THUYẾT bên trên sẽ thấy:
*Cl khi đứng chung với kim loại; LUÔN LUÔN có số oxi hóa là -1
*vậy nếu gọi soh của Fe là x thì có: x + 2.(-1) = 0 nên x = +2 (hoặc tính nhẩm cho nhanh)
Vẽ CTCT chỉ với phân tử phức tạp hoặc chất hữu cơ thôi (hồi xưa thấy đề thi hay cho, bây giờ bớt thấy rồi). Còn nếu vẽ CTCT thì
*Cl—Fe—Cl ; vì độ âm điện (khả năng rút e) của Cl > Fe nên mỗi Cl sẽ rút 1e của Fe. Vẽ Cl kéo e về phía mình như vầy nè Cl—<- Fe –>–Cl
*vậy 2Cl sẽ rút hết 2e của Fe
*hậu quả mỗi Cl sẽ có soh -1; và Fe mất 2e nên có soh +2
Nhưng nên tính soh của FeCl2 theo cách 😵💫 dễ hơn (và luôn tính như vậy) so với vẽ CTCT.
Còn câu hỏi gì thì viết lên đây nha Phước.
Trân trọng.
Dạ thầy cho con hỏi là với các đơn chất có nhiều số oxi hoá không cố định thì khi tạo thành hợp chất như FeS2,FeS,… thì mình tính số oxi hoá như thế nào vậy ạ ?
Con cảm ơn thầy nhiều ạ.