Tương tác Van Der Waals
Tương tác Van der Waals là loại yếu nhất trong tất cả lực hấp giữa các phân tử. Tuy nhiên, với vô số tương tác, lực hút có thể rất mạnh.

Tương tác Van Der Waals, hay Liên kết Van Der Waals (đặt theo tên của nhà vật lý người Hà Lan – Johannes Diderik Van Der Waals) mô tả loại tương tác phụ thuộc vào khoảng cách giữa các phần tử, công bố năm 1873.
Lực hấp dẫn Van Der Waals cũng như “Một cây làm chẳng nên non; Ba cây chụm lại nên hòn núi cao“.
Cũng có thể bạn cần phân biệt:
- Lực hấp dẫn liên phân tử (như tương tác Van Der Waals): lực hấp dẫn giữa phân tử này với phân tử khác.
- Lực hút nội phân tử (như liên kết ion, liên kết cộng hóa trị): lực hấp dẫn chỉ trong 1 phân tử riêng lẻ.
Phân tử có cực âm và cực dương tức thời
Hồ cá và Con Cá
Trong 1 hồ cá, các con cá không ngừng bơi bơi. Khi các con cá di chuyển tập trung về 1 phía bất kì của hồ cá, sẽ hình thành nên các lưỡng cực tạm thời – tức là 2 cực:
- 1 cực có nhiều cá,
- 1 cực có ít cá hơn.

Mình cũng sẽ chẳng cần thắc mắc (mặc dù có đôi lúc, mình giải thích được): tại sao đám cá kì vậy, bơi lội tùm lum mà chẳng chịu bơi mỗi con một khoảng không gian bằng nhau cho công bằng!
Phân tử và Electron
Bây giờ mình thay hồ cá bằng phân tử; con cá bằng electron. Tự dưng mình có phát biểu giống SGK như sau:
Trong 1 phân tử, các electron không ngừng chuyển động. Khi các electron di chuyển tập trung về 1 phía bất kì của phân tử, sẽ hình thành nên các lưỡng cực tạm/tức thời – tức là 2 cực:
- 1 cực có nhiều electron nên tích điện âm,
- 1 cực có ít electron hơn nên tích điện dương.
Cũng như trên, mình không cần phải day dứt: vì sao electron lại cư xử như vậy; bởi vì …điều này là một sự thật hiển nhiên.
Hai trạng thái lưỡng cực tạm thời của 1 phân tử vẽ như sau:
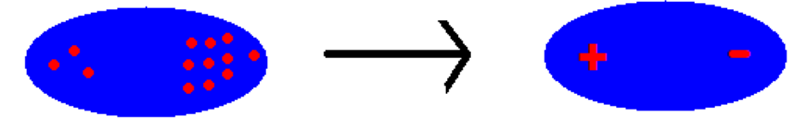
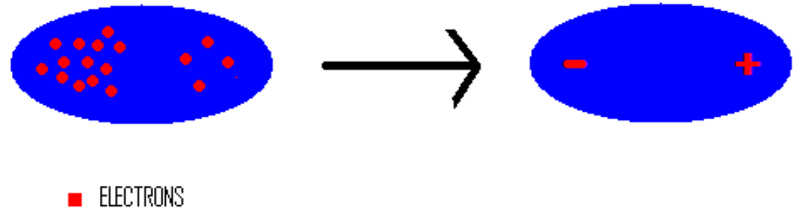
Lưỡng cực cảm ứng và Tương tác Van Der Waals
Điều gì xảy ra khi 1 phân tử lưỡng cực tạm thời bơi đến gần 1 phân tử khác
Khi một phân tử (X) có cực dương và cực âm …chạy đến đứng kế bên 1 phân tử (Y) khác,
- đầu dương của X sẽ hút các electron của Y dồn về phía mình.
- kết quả làm phân tử Y có 1 cực nhiều electron; cực còn lại ít electron hơn. Tức là …phân tử Y cũng biến thành 1 lưỡng cực. Các nhà khoa học gọi đây là lưỡng cực cảm ứng.
Tương tác Van Der Waals
Quá hình thành lưỡng cực cảm ứng như trên xảy ra tiếp tục – lặp lại như hiện tượng Domino. Lúc này, một mạng lưới với rất nhiều tương tác lưỡng cực ảm ứng hình thành – gọi là tương tác Van Der Waals. Và đương nhiên, lúc này xuất hiện lực hút tĩnh điện giữa các phân tử; khiến các phân tử được kết dính với nhau hơn.

Tất cả phân tử đều có tương tác Van Der Waals
Mọi phân tử trên cuộc đời này đều có lực hấp dẫn lẫn nhau, mặc dù một số trường hợp, lực Van Der Waals rất yếu (giống như con người và mọi vật, luôn có lực thu hút lẫn nhau; nhưng đôi khi rất mạnh, đôi lúc rất yếu – yếu đến nỗi thấy mà ghét!).


Ví dụ:
- Tương tác Van Der Waals giữa các phân tử khí H2 rất yếu, nếu bạn làm cho các phân tử khí H2 chạy chậm lại bằng cách làm lạnh đến -252 0C, thì tương tác Van Der Waals sẽ đủ lớn để các phân tử khí H2 dính kết lại với nhau thành H2 lỏng. Nếu tiếp tục làm lạnh đến -259 0C, H2 lỏng chuyển thành H2 rắn luôn.
- Tương tác Van Der Walls giữa các phân tử khí He thậm chí còn yếu hơn; các phân tử He sẽ không dính vào nhau để tạo thành chất lỏng cho đến khi nhiệt độ giảm xuống -269°C.
Yếu tố ảnh hưởng đến độ lớn tương tác Van Der Waals
Kích thước phân tử càng lớn, lực tương tác Van Der Waals càng mạnh
Phân tử càng lớn; nghĩa là có đường kính lớn = có nhiều lớp electron = có nhiều electron. Khi đó:
- Khoảng cách giữa cực ít và cực nhiều electron càng xa; tức lưỡng cực càng ổn định (hãy tưởng tượng là đường xa nên đám electron lười chạy về!, cứ nấn ná ở 1 nơi),
- Có nhiều electron nên giá trị điện âm – điện dương càng lớn,
- Kết quả làm lực hút tương tác lớn theo, khiến các phân tử “dính chặt” vào nhau hơn.
Ví dụ, nhiệt độ sôi của khí hiếm (khí trơ) tăng dần như bảng sau (do từ He đến Rn, số electron/đường kính phân tử tăng dần):
| Khí He | -269 0C |
| Khí Ne | -246 0C |
| Khí Ar | -186 0C |
| Khí Kr | -162 0C |
| Khí Xe | -108 0C |
| Khí Rn | -62 0C |
Phân tử càng dài – càng mỏng, lực tương tác Van Der Waals càng mạnh
So với phân tử ngắn-mập, phân tử dài-mỏng (chứa cùng số electron) có khả năng phát triển các lưỡng cực tạm thời lớn hơn. Mặt khác, các phân tử dài-mỏng cũng dễ dàng nằm sít gần nhau hơn. Tất cả những điểm hấp dẫn này khiến lực tương tác Van Der Waals tăng lên đáng kể.
Ví dụ (lớp 11 sẽ học 2 phân tử này): [A] Butane và [B] 2-methylbutane đều có công thức phân tử C4H10; trong đó
- ngắn-mập là [B] CH3-CH(CH3)-CH3 có t0 sôi thấp là -11,7 0C
- dài-mỏng là [A] CH3-CH2-CH2-CH3 có t0 sôi cao hơn là -0,7 0C
Tóm tắt
Tương tác Van Der Waals:
- là lực tương tác yếu giữa các phân tử.
- hình thành từ các lưỡng cực tạm/tức thời và lưỡng cực cảm ứng.
- làm tăng t0 nóng chảy và t0 sôi của chất.
Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác Van Der Waals tăng; khiến các phân tử “dính vào nhau” chặt hơn.
*Bài viết có tham khảo tài liệu tại chemguide.co.uk; chem.libretexts.org; Sách Giáo Khoa chương trình 10 mới năm 2022 của VN.
Liên kết nhanh
Đọc thêm các bài viết của Hóa lớp 10 tại đây.
Mình là người tự mình thực hiện toàn bộ dự án này – bao gồm xây dựng trang web, viết nội dung, tìm tài liệu tham khảo. Vui lòng xem xét QUYÊN GÓP để hỗ trợ W3chem CHỈ BẰNG CÁCH CHIA SẺ BÀI VIẾT NÀY LÊN MẠNG XÃ HỘI; bởi vì trong tương lai, bạn sẽ cho mình nhiều thời gian để làm việc trên W3chem, cũng có nghĩa bạn có thể nhận thêm nhiều nội dung mới nhanh hơn tại W3chem.
Mình cảm ơn bạn rất nhiều ⤵






